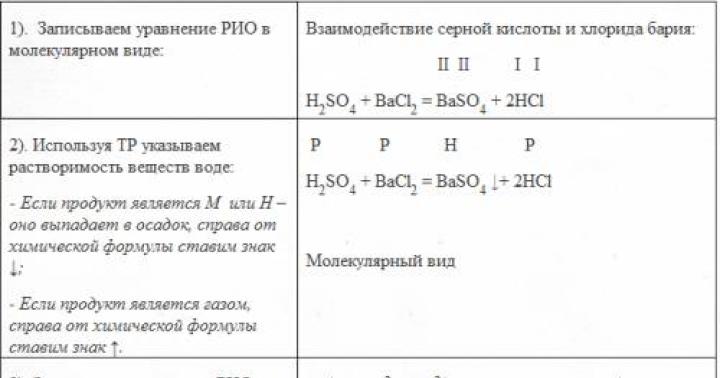
Рабочая программа. Метод молекулярных орбиталей. Молекулярная орбиталь как линейная комбинация атомных орбиталей. Понятие о связывающих и разрыхляющих молекулярных орбиталях. Порядок связи. Последовательность увеличения энергии молекулярных орбиталей элементов 1-го и 2-го периодов ПСЭМ. Электронные формулы молекул. Принципы заполнения молекулярных орбиталей. Молекулярные диаграммы двухатомных гомо - и гетероядерных молекул. Магнитные свойства молекул (диамагнетизм и парамагнетизм).
Метод валентных связей позволяет во многих случаях объяснить образование химической связи и предсказать целый ряд свойств молекул. Тем не менее известно много соединений, существование и свойства которых не могут быть объяснены с позиций метода ВС. Более универсальным является метод молекулярных орбиталей (МО).
Метод ВС основан на идее образования химической связи парой электронов, принадлежащей двум атомам. Согласно методу МО электроны, образующие химическую связь, движутся в поле, образуемом ядрами всех атомов, составляющих молекулу, т.е. электроны принадлежат всем атомам молекулы. Следовательно, молекулярные орбитали являются в общем случае многоцентровыми.
Согласно методу МО все электроны данной молекулы, участвующие в образовании химической связи, распределяются по соответствующим молекулярным орбиталям. Каждая молекулярная орбиталь, как и атомная орбиталь, характеризуется своим набором квантовых чисел.
Молекулярные орбитали получают сложением или вычитанием исходных атомных орбиталей. Если МО образуется из атомных орбиталей ψ А и ψ В, то при их сложении возникает МО ψ + , а при вычитании – ψ - :
ψ + = с 1 ψ А + с 2 ψ В,
ψ - = с 3 ψ А – с 4 ψ В,
где с 1 – с 4 – коэффициенты, определяющие долю участия соответствующей атомной орбитали в МО.
Эта операция носит название линейной комбинации атомных орбиталей , поэтому метод носит название МО ЛКАО (молекулярная орбиталь есть линейная комбинация атомных орбиталей). Число образующихся МО равно числу исходных АО. Молекулярные орбитали образуются только из атомных орбиталей с близкими энергиями. Большие различия в энергиях исходных АО препятствуют образованию МО. Орбитали внутренних энергетических уровней не участвуют в образовании МО.
При сложении АО образуются связывающие МО с энергией, меньшей, чем у исходных АО. Вычитание АО ведет к образованию разрыхляющих МО , имеющих более высокую энергию по сравнению с исходными АО. Схема образования связывающих и разрыхляющих МО из 1s атомных орбиталей приведена на рис. 6.11.
Электроны, находящиеся на МО, характеризуются четырьмя квантовыми числам
n – главное квантовое число;
l – орбитальное квантовое число;
Рис. 6.11. Схема образования связывающей (σ1s) и разрыхляющей (σ*1s) молекулярных орбиталей
λ – молекулярное квантовое число, аналогичное магнитному квантовому числу m l ; может принимать значения 0; ±1;±2, обозначаемые буквами σ, π, δ соответственно;
m s – спиновое квантовое число.
Заполнение молекулярных орбиталей электронами подчиняется принципу Паули, принципу наименьшей энергии и правилу Гунда.
Последовательность увеличения энергий МО, т.е. последовательность заполнения, для элементов начала 2-го периода (для азота включительно) имеет вид
σ1s<σ*1s<σ2s<σ*2s<π2p х =π2p z <σ2p y < π*2p х =π*2p z <σ*2p y ,
а для элементов конца 2-го периода (O, F, Ne) –
σ1s<σ*1s<σ2s<σ*2s< σ2p y <π2p х =π2p z < π*2p х =π*2p z <σ*2p y .
Полуразность числа электронов на связывающих (N св) и разрыхляющих (N р) орбиталях носит название порядка (кратности) связи n:
Молекула образуется, если n>0, т.е. связь может быть образована не только парой, но и одним электроном, и, следовательно, порядок связи может быть не только целым, но и дробным числом. С увеличением порядка возрастает энергия связи.
Двухатомные гомоядерные молекулы элементов 1-го периода . Простейшей молекулой является молекулярный ион . В соответствии с принципом наименьшей энергии единственный электрон молекулы располагается на σ1s МО. Следовательно, электронная формула молекулярного иона запишется как
Электронная формула может быть представлена графически в виде молекулярной (энергетической) диаграммы (рис. 6.12), показывающей относительные энергии атомных и молекулярных диаграмм и число электронов на них.
Порядок связи иона n=(1-0)/2=0,5, следовательно, эта частица может существовать.
|



Рис. 6.12. Молекулярная диаграмма
Молекулярный ион имеет один электрон, поэтому он является парамагнитным , т.е. втягивается в магнитное поле. Все вещества, имеющие неспаренные электроны, относятся к парамагнетикам.
Молекула водорода Н 2 содержит два электрона, и ее электронная формула имеет следующий вид:
Н 2 [(σ1s) 2 ].
Из молекулярной диаграммы (рис. 6.13) следует, что порядок связи молекулы водорода равен единице. Увеличение порядка связи от 0,5 до 1 при переходе от к Н 2 сопровождается увеличением энергии связи от 236 до 436 кДж/моль и уменьшением длины связи от 0,106 до 0,074 нм.
Электроны молекулы Н 2 спарены, и по этой причине молекулярный водород диамагнитен , т.е. выталкивается из магнитного поля. К диамагнетикам относятся все вещества, не содержащие неспаренных электронов.

Рис.6.13. Молекулярная диаграмма Н 2
Второй элемент 1-го периода гелий в соответствии с представлениями метода МО может образовывать парамагнитный молекулярный ион (n=0,5), а молекула Не 2 существовать не может, т.к. число электронов на связывающей и разрыхляющей молекулярных орбиталях одинаково и порядок связи равен нулю.
Двухатомные гомоядерные молекулы элементов 2-го периода . Рассмотрим в качестве примера молекулу кислорода. Двенадцать электронов внешних уровней двух атомов кислорода (2s 2 2p 4) заполнят молекулярные орбитали следующим образом:
О 2 .
Cимвол К в электронной формуле означает, что электроны К-уровня (1s 2) не участвуют в образовании молекулярных орбиталей. Молекулярная диаграмма молекулы кислорода представлена на рис. 6.14. В соответствии с правилом Гунда два электрона на орбиталях π2p x и π2p z являются неспаренными и молекула кислорода является парамагнитной, что подтверждено экспериментально. Отметим, что в рамках метода валентных связей невозможно объяснить парамагнетизм кислорода. Порядок связи в молекуле О 2 n=(8-4)/2=2.

Рис. 6.14. Молекулярная диаграмма О 2
Порядок связи в двухатомных гомоядерных молекулах элементов 2-го периода увеличивается от 1 у В 2 до 3 у N 2 , а затем уменьшается до 1 у F 2 . Образование молекул Be 2 и Ne 2 невозможно, т.к. порядок связи в этих молекулах равен нулю.
Двухатомные гетероядерные молекулы элементов 2-го периода . Атомные орбитали различных атомов вносят различный вклад в молекулярные орбитали, или, что то же самое, коэффициенты с i в уравнениях
ψ + = с 1 ψ А + с 2 ψ В;
ψ - = с 3 ψ А – с 4 ψ В
не равны единице. В связывающую орбиталь больший вклад вносит атомная орбиталь более электроотрицательного элемента, а разрыхляющую – АО более электроположительного элемента. Если атом В более электроотрицателен, чем атом А, то с 2 >с 1 , а с 3 >с 4 . Связывающие МО по энергии ближе к АО более электроотрицательного атома, а разрыхляющие – к АО более электроположительного атома.
В качестве примера приведем молекулу СО. Десять электронов атомов углерода и кислорода разместятся по МО следующим образом:
СО .
Порядок связи в молекуле СО n=(8-2)/2=3. Молекула СО парамагнитна. Молекулярная диаграмма приведена на рис. 6.15.

Рис. 6.15. Молекулярная диаграмма СО
Металлическая связь
Рабочая программа. Металлическая связь. Энергетическая зона, валентная зона, зона проводимости, запрещённая зона. Проводники, полупроводники, изоляторы.
Металлы, составляющие большую часть периодической системы Д.И. Менделеева, обладают рядом особенностей:
1) металлическим блеском, т.е. высокой отражательной способностью к свету;
2) высокими тепло- и электропроводностями;
3) пластичностью и ковкостью.
Эти свойства металлов объясняются особым типом ковалентной связи, называемым металлической связью .
С позиций метода молекулярных орбиталей кристалл металла представляет собой одну огромную молекулу. Атомные орбитали атома перекрываются с атомными орбиталями соседних атомов, образуя связывающие и разрыхляющие МО. Эти
орбитали перекрываются, в свою очередь, с атомными орбиталями следующих соседей и т.д.
В результате происходит перекрывание атомных орбиталей всех атомов, составляющих кристалл металла, и образуется огромное число МО, распространяющихся на весь кристалл (рис. 6.16).
Металлы имеют высокие координационные числа, обычно 8 или 12, т.е. каждый атом окружен 8 или 12 соседями. Например, координационое число лития – 8. Следовательно, 2s-атомная орбиталь лития перекрывается с 2s-атомными орбиталями восьми соседних атомов, а те, в свою очередь, перекрыва- ются с атомными орбиталями своих соседей и т.д. В 1 моль ли-
тия происходит перекрывание 6,02 . 10 23 атомных орбиталей с образованием такого же количества молекулярных орбиталей. Различие в энергиях этих орбиталей очень мало и составляет величину порядка 10 -22 эВ (10 -21 кДж). Молекулярные орбитали образуют энергетическую зону . Заполнение энергетической зоны электронами происходит в соответствии с правилами
наименьшей энергии, правилом Гунда и запретом Паули. Следовательно, максимальное количество электронов в энергетической зоне, образованной s-электронами, составит 2N, где N – число атомов в кристалле. Соответственно, в зонах, образованных p-, d- и f-орбиталями, может находиться до 6N, 10N или 14N электронов.
 |
Рис. 6.16. Схема образования энергетической зоны
Зона, заполненная электронами, осуществляющими химическую связь, называется валентной зоной . Эта зона может быть заполнена в различной степени, в зависимости от природы металла, его строения и т.д. Выше валентной зоны располагается свободная зона, называемая зоной проводимости . В зависимости от природы атомов и строения кристаллической решетки валентная зона и зона проводимости могут перекрываться или быть отделенными энергетическим разрывом, называемым запрещенной зоной . В случае перекрывания валентной зоны и зоны проводимости вещества относятся к металлам. Если ширина запрещенной зоны составляет ΔЕ=0,1÷3,0 эВ, то вещества относятся к полупроводникам, если ΔЕ>3 эВ – то к изоляторам.
Валентная зона металлов обычно заполнена электронами неполностью. Поэтому перевод электронов в зону проводимости требует очень малой затраты энергии, что и объясняет высокие электро- и теплопроводность металлов.
Межмолекулярная связь
Рабочая программа. Межмолекулярная связь. Силы Ван-дер-Ваальса: ориентационные, индукционные, дисперсионные. Водородная связь. Влияние на физико-химические свойства веществ.
Между электронейтральными атомами и молекулами в твердом, жидком и газообразном состояниях всегда действуют силы притяжения. Об этом свидетельствуют, например, неидеальность реальных газов, понижение температуры газов при расширении, существование благородных газов в конденсированном состоянии и др.
Различают два типа межмолекулярных взаимодействий:
1) силы Ван-дер-Ваальса;
2) водородная связь.
Иногда к межмолекулярным взаимодействиям относят донорно-акцепторную и металлическую связь.
Силы Ван-дер-Ваальса. Основными свойствами сил Ван-дер-Ваальса являются невысокая энергия (до ~40 кДж/моль) и ненасыщаемость. Различают три типа сил Ван-дер-Ваальса: ориентационные, индукционные и дисперсионные.
Ориентационное (диполь-дипольное) взаимодействие имеет место только между полярными молекулами. При достаточно малых расстояниях между молекулами противоположно заряженные концы диполей притягиваются, а одноименно заряженные – отталкиваются (рис. 6.17,а) Чем больше дипольные моменты молекул, тем сильнее ориентационное взаимодействие. Ориентационное взаимодействие ослабляется при увеличении температуры и расстояния между молекулами.
Индукционное взаимодействие осуществляется между молекулами разной полярности. Под действием электрического поля более полярной молекулы неполярная или малополярная молекула поляризуется, т.е. в ней возникает (индуцируется) диполь или увеличивается дипольный момент (рис. 6.17,б). Энергия индукционного взаимодействия определяется величиной дипольного момента полярной молекулы, расстоянием между молекулами и поляризуемостью неполярной молекулы, т.е. ее способностью к образованию диполя под действием внешнего поля.
Дисперсионное взаимодействие является наиболее универсальным, т.е. действует между любыми молекулами независимо от их полярности. Ядро атома и электрон образуют мгновенные диполи , индуцирующие мгновенные диполи у соседних частиц (рис. 6.17,в). Синхронное движение мгновенных диполей разных молекул ведет к понижению энергии системы и притяжению частиц. Энергия дисперсионного взаимодействия увеличивается с ростом поляризуемости частиц, уменьшением расстояния между ними и не зависит от температуры.

Рис. 6.17. Вандерваальсовы взаимодействия: а – ориентационное; б – индукционное; в – дисперсионное
Энергия вандерваальсовых взаимодействий обратно пропорциональна шестой степени расстояния между центрами взаимодействующих частиц. При сильном сближении молекул начинают действовать силы отталкивания между электронными оболочками, которые уравновешивают силы притяжения.
Относительные величины различных типов вандерваальсова взаимодействия для некоторых веществ приведены в табл. 6.1.
Таблица 6.1. Вклад отдельных составляющих в энергию вандерваальсова взаимодействия
Из табл. 6.1 следует, что увеличение дипольного момента ведет к росту ориентационного и индукционного взаимодействий, а увеличение поляризуемости сопровождается усилением дисперсионного взаимодействия.
Водородная связь является особым типом межмолекулярного взаимодействия, который имеет место между молекулами соединений, содержащих группировки F-H, O-H, N-H, т.е. атом водорода и элемент с очень высокой электроотрицательностью.
Электронная плотность связи Э-Н смещена в сторону электроотрицательного элемента. Атом водорода теряет электронную оболочку и превращается в протон. Благодаря своим малым размерам и отсутствию отталкивания электронных оболочек, протон способен вступать в электростатическое взаимодействие с электронной оболочкой сильно электроотрицательного атома соседней молекулы. Одновременно водород выступает в роли акцептора электронной пары, предоставляемой электроотрицательным атомом соседней молекулы.
![]() .
.
Силы Ван-дер-Ваальса и отталкивания также вносят вклад в образование водородной связи.
В отличие от сил Ван-дер-Ваальса водородная связь обладает свойствами направленности и насыщаемости.
Энергия водородной связи невелика, составляет от 8 до 40 кДж/моль и возрастает в ряду N-H < O-H < F-H. Тем не менее наличие водородной связи оказывает сильное влияние на физико-химические свойства веществ. Так, молекула воды может участвовать в образовании четырех водородных связей. Это ведет к образованию прочных ассоциатов (Н 2 О) n , что объясняет высокую температуру плавления и кипения воды по сравнению с ее аналогом – H 2 S (t кип =-61,8 о С), высокую теплоёмкость (4,218 кДж/кг К при температуре 273К), высокую энтальпию испарения (2250 кДж/кг). Сероводород как соединение с более высокой молекулярной массой должен был бы иметь более высокую температуру кипения, чем вода. Отсутствие сильных водородных связей у H 2 S приводит к обратной зависимости.
Водородная связь объясняет образование ассоциатов фторида водорода (HF) n , димеризацию карбоновых кислот:
![]()
Очень многие химические соединения содержат химические связи N-H и O-H, следовательно, водородные связи встречаются очень часто. Особо важную роль водородные связи играют для биологических объектов. Так, двойные спирали ДНК соединяются межмолекулярными водородными связями.
Вопросы для самостоятельной подготовки
1.Рассмотрите образование ковалентной связи на примере молекулы водорода. Приведите график зависимости потенциальной энергии системы из двух атомов водорода от межъядерного расстояния.
2. Как объяснить большую устойчивость молекулы F 2 по сравнению с системой из двух свободных атомов фтора?
3.Приведите электронные структуры атомов элементов 2-го периода в основном и возбужденном состояниях.
4. Почему атом аргона не образует химических связей?
5. Почему атом кислорода образует 2 химические связи, а атом серы – 6?
6. Гибридизация атомных орбиталей. Факторы, благоприятствующие гибридизации. Ориентация гибридных орбиталей в пространстве. sp-, sp 2 -, sp 3 - и sp 3 d 2 - гибридизация.
7. Приведите примеры влияния несвязывающих (неподелённых) электронных пар на стереохимию молекул.
8. Как влияет положение элемента в ПСЭМ на устойчивость гибридизации атомных орбиталей? Приведите примеры.
9. Определите тип гибридизации орбиталей центрального атома в ионе гидроксония Н 3 О + . Изобразите геометрическую форму этой частицы.
10. В чём особенности донорно-акцепторного механизма образования ковалентной связи? Приведите примеры частиц, способных играть роль донора и акцептора электронной пары.
11. Какие факторы влияют на энергию химической связи?
12. Расположите следующие соединения в порядке возрастания длины связи: NaH, NaF, NaCl, NaBr.
13. Расположите следующие связи в порядке увеличения их энергии: а) О-О; О=О; б)О-О; S-S; в)Н-F; H-Cl; H-Br; г)Li-H; Be-H; B-H; C-H.
14. Какая из связей прочнее: а) C-F или C-Br; б) C=O или С-О; в) O=O или S=S?
15. В каких из следующих соединений связь центрального атома является насыщенной: а) IF 3 ; IF 5 ; IF 7 ; б)Cl 2 O; ClO 2 ; Cl 2 O 7 ?
16. Определите координационное число атома алюминия в соединениях: а) Li; б) Na 3 .
17. Расположите следующие химические связи в порядке увеличения полярности: Na-O; Na-F; Na-N.
18. Какая из молекул HF, HCl, HBr, HI имеет наибольшую длину диполя?
19. Как изменяется полярность связи в ряду HF, HCl, HBr, HI?
20. Какие факторы влияют на величину дипольного момента следующих молекул: а) NH 3 , б) РН 3 , в) AsH 3 ? Какая из этих молекул может иметь наибольший дипольный момент?
21. Какой тип связи реализуется в следующих молекулах: HCl, Cl 2 , RbСl, ClF?
22. Расположите следующие ионы в порядке уменьшения их поляризующей способности: Na + ; Mg 2+ ; Al 3+ .
23. Расположите следующие ионы в порядке увеличения их поляризуемости:F - ; Cl - ; Br - ;I - .
24. В водном растворе какой соли связь О-Н в молекуле воды будет поляризована в большей степени: NaCl; MgCl 2 ; AlCl 3 ? Почему?
25. В чем причина роста силы галогенводородных кислот, наблюдающегося при увеличении порядкового номера атома галогена?
26. В чем причина увеличения силы гидроксидов щелочных и щелочноземельных элементов, наблюдающегося при увеличении заряда ядра атомов металла?
27. Почему серная кислота сильнее сернистой?
28. Почему уксусная кислота СН 3 СООН намного слабее трифторуксусной кислоты СF 3 СООН?
29. Определите сколько σ- и π-связей содержит молекула бутадиена CH 2 CHCHCH 2 ?
Ответ: 9 σ- и 2 π-связи.
30. Определите сколько σ- и π-связей содержит молекула винилацетилена CHCCHCH 2 ?
Ответ: 7 σ- и 3 π-связи.
31. Изложите основные положения метода молекулярных орбиталей.
32. В чём состоит основное отличие метода МО от метода ВС?
33. Составьте электронную формулу и приведите молекулярную диаграмму молекулы азота. Определите порядок связи и укажите магнитные характеристики молекулы.
34. Составьте электронную формулу и приведите молекулярную диаграмму молекулы фтора. Определите порядок связи и укажите магнитные характеристики молекулы.
35. Составьте электронную формулу и приведите молекулярную диаграмму молекулы оксида азота (II). Определите порядок связи и укажите магнитные характеристики молекулы.
36. Объясните с позиций метода молекулярных орбиталей увеличение энергии связи в ряду фтор, кислород, азот.
37. Как изменится энергия химической связи при переходе от F 2 к и ?
38. Какая из перечисленных молекул не должна существовать: а) С 2 , б) Li 2 , в) Ве 2 , г) В 2 ?
39. Какие физические свойства характерны для металлов?
40. Опишите особенности химической связи в металлах и её характеристики.
41. В чём причины различия электропроводностей металлов, полупроводников и изоляторов?
42. Приведите примеры физических явлений, указывающих на наличие взаимодействий между нейтральными атомами и молекулами.
43. Опишите механизм возникновения и характеристики вандерваальсовых взаимодействий.
44. Какие типы вандерваальсовых взаимодействий могут иметь место для следующих веществ: гелия, метана, азота, бромистого водорода?
45. Какой тип сил Ван-дер-Ваальса преобладает в каждом из следующих веществ: O 2 , H 2 O, OF 2 ?
46. Опишите взаимодействия, вносящие свой вклад в образование водородной связи.
47. Какой тип связи реализуется при образовании иона Н 3 О + из протона и молекулы воды?
48. Для каких из следующих соединений возможны водородные связи: SiH 4 , HCOOH, CH 3 CH(NH 2)COOH, H 2 O 2 , HCl?
49. Почему температура кипения аммиака NH 3 выше, чем у фосфина PH 3 ?
50. Почему одноосновная фтористоводородная кислота может образовывать кислые соли, например NaHF 2 , а соляная кислота аналогичные соединения не образует?
6.6. Задания для текущих и промежуточных контролей
1. Объясните термин «перекрывание атомных орбиталей».
2. Можно ли сказать, что благородные газы He, Ne и другие состоят из молекул?
3. Почему хлорводородная кислота сильнее фторводородной?
4. Что является причиной образования любой химической связи? Каким энергетическим эффектом сопровождается этот процесс?
5. Как изменяется прочность связи в ряду HF, HCl, HBr, HI? Укажите причины этих изменений.
6. Предскажите, какая из связей прочнее: а) С – F или C – Br; б) С = О или С – О; в) О – О или S – S.
7. Расположите следующие связи в порядке увеличения полярности: Na – O, Na – F, Na – N.
8. Расположите указанные связи в порядке возрастания полярности: а) H – F, H – C, H – H; б) P – S, Si – Cl, Al – Cl.
9. Как называется расстояние между центрами ядер атомов в молекуле и каким образом оно влияет на прочность химических связей?
10. Почему и как влияет размер атомов на длину и энергию образующейся между ними связи?
11. Чем объясняется большая устойчивость системы из двух связанных атомов (например, Н 2) по сравнению с системой из двух свободных атомов (2Н)?
12. Чем объясняется способность атомов многих элементов к образованию числа связей, превышающих число неспаренных электронов в их атомах в основном состоянии?
13. Укажите факторы, способствующие гибридизации атомных орбиталей.
14. Объясните, каким образом атом углерода, имеющий два неспаренных электрона, может проявлять ковалентность, равную четырем?
15. Сравните механизм образования ковалентных связей в молекулах СН 4 , NH 3 и в ионе .
16. Приведите схему перекрывания атомных орбиталей в молекулах BeCl 2 и BF 3 .
17. Какая из молекул HF, HCl, HBr или HI имеет наибольшую длину диполя?
18. Расположите указанные связи в порядке возрастания полярности:
а) H – F, F – C, F – F;
б) C – N, B – O, Li – l;
в) P – S, Si – Cl, Al – Cl
19. Расположите в порядке возрастания степени ионности связи В – Cl, Na – Cl, Ca – Cl, Be – Cl.
20. Для каких связей длина диполя а) равна нулю; б) меньше длины связей; в) равна длине связей?
21. Укажите донор и акцептор в реакции Н 2 О + Н + = Н 3 О + .
22. Какая из следующих молекул должна иметь наибольший дипольный момент: NH 3 , PH 3 , AsH 3 , BH 3 ?
23. Какая связь называется водородной? Как она влияет на физические свойства веществ?
24. Рассмотрите с позиций метода МО частицу . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
25. Рассмотрите с позиций метода МО частицу . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
26. Рассмотрите с позиций метода МО частицу . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
27. Рассмотрите с позиций метода МО частицу . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
28. Рассмотрите с позиций метода МО частицу . Может ли эта частица существовать? Каков порядок связи и магнитные свойства этой частицы?
29. Рассмотрите с позиций метода МО молекулу . Каков порядок связи и магнитные свойства этой молекулы?
30. Рассмотрите с позиций метода МО молекулу . Каков порядок связи и магнитные свойства этой молекулы?
Библиографический список
1.Пирогов, А.И. Общая химия: учеб. пособие /А.И. Пирогов; Иван. гос. энерг. ун-т. – Иваново,2010. – 220 с.
2.Пирогов, А.И., Общая химия: учеб.-метод. программированное пособие/А.И. Пирогов,А.В. Ионов; Иван. гос. энерг. ун-т. – Иваново,2012. – 76 с.
3.Пакет заданий по текущим и промежуточным контролям: метод. разработка для студентов I курса / И.М. Арефьев [и др.] ; под ред. А.И. Пирогова; Иван. гос. энерг. ун-т. – Иваново, 2011. – 72 с.
4.Методические указания к выполнению лабораторных работ по общей химии/ В.К. Абросимов [и др.]; под ред. В.К. Абросимова; Иван. гос. энерг. ун-т. – Иваново, 2000. – 44 с.
5.Коровин, Н.В. Общая химия (бакалавриат)/ Н.В. Коровин. – 13-е изд. – М.: Академия, 2011. – 496 с.
6. Задачи и упражнения по общей химии: учеб. пособие / Б.И. Адамсон [и др.] ; под ред. Н.В. Коровина. – 3-е изд. – М.: Высш. шк., 2006. – 255 с.
7.Коровин, Н.В. Лабораторные работы по химии: учеб. пособие для вузов/Н. В. Коровин [и др.] – 4-е изд.– М.: Высш. шк., 2007 – 256 с.
8.Глинка, Н.Л. Общая химия: учеб. для бакалавров / Н.Л. Глинка; под. ред. В.А. Попкова, А.В. Бабкова. – 19-е изд., перераб. и доп. – М.: Юрайт, 2014. – 900 с. – (Серия «Бакалавр. Базовый курс»).
9.Глинка, Н.Л. Задачи и упражнения по общей химии: учеб.-практ. пособие для бакалавров / Н.Л. Глинка; под. ред. В.А.Попкова, А.В. Бабкова. – 14-е изд. – М.: Юрайт, 2014. – 236 с. – (Серия «Бакалавр. Базовый курс»).
10.Глинка, Н.Л. Практикум по общей химии: учеб. пособие для академ. бакаравриата / Н.Л. Глинка; под. ред. В.А. Попкова, А.В. Бабкова, О.В. Нестеровой. – М.: Юрайт, 2014. – 248 с. – (Серия «Бакалавр. Академический курс»).
11.Степин, Б.Д. Применение международной системы единиц физических величин в химии / Б.Д. Степин. – М.: Высш. шк., 1990. – 96 с.
Метод валентных связей дает теоретическое обоснование широко применяемым химиками структурным формулам и позволяет правильно определить структуру практически всех соединений s – и p – элементов. Большое достоинство метода в его наглядности. Однако представление о локализованных (двухцентровых, двухэлектронных) химических связях оказывается слишком узким для объяснения многих экспериментальных фактов. В частности, метод валентных связей несостоятелен для описания молекул с нечетным числом электронов, например, H , H , бораны, некоторые соединения с сопряженными связями, ряд ароматических соединений, карбонилы металлов, т.е. молекулы с дефицитом электронов или их избытком (H ). Обнаружились непреодолимые трудности использования метода валентных связей для объяснения валентности элементов восьмой группы с фтором и кислородом (XeF 6 , XeOF 4 , XeO 3 и др.), металлов в ”сэндвичевых” металлоорганических соединениях, например, железа в ферроцене
Fe (C 5 H 5) 2 , где он должен был бы образовать связи с десятью атомами углерода, не имея такого количества электронов на внешней оболочке.
На основе метода ВС трудно объяснить и то, что отрыв электронов от некоторых молекул приводит к упрочнению химической связи. Так, энергия разрыва связи в молекуле F 2 составляет 38 ккал/моль, а в молекулярном ионе F - 76 ккал/моль. Этот метод не объясняет и парамагнетизм молекулярного кислорода O 2 и B 2 .
Более общим и универсальным оказался метод молекулярных орбиталей (МО) , при помощи которого удается объяснить факты, непонятные с позиции метода ВС . Значительный вклад в разработку метода МО внес американский ученый Р. Малликен (1927 – 1929 гг).
Основные понятия. В своей основе метод МО распространяет квантово - механические закономерности, установленные для атома, на более сложную систему - молекулу. В основе метода молекулярных орбиталей лежит представление об ""орбитальном"" строении молекулы, т.е. предположение о том, что все электроны данной молекулы (как и в атоме) распределяются по соответствующим орбиталям. Каждая орбиталь характеризуется набором квантовых чисел, отражающих свойства электрона в данном энергетическом состоянии. Особенность метода МО заключается в том, что в молекуле имеется нескольких атомных ядер, т.е. в отличие от одноцентровых атомных орбиталей молекулярные орбитали несколькоцентровые (общие для двух и большего числа атомных ядер). По аналогии с атомными s -, p -, d -, f - орбиталями молекулярные орбитали обозначаются греческими буквами σ -, π, δ -, φ .
Основная проблема метода МО - нахождение волновых функций, описывающих состояние электронов на молекулярных орбиталях. Согласно одному из вариантов метода молекулярных орбиталей, названным линейной комбинацией атомных орбиталей (МОЛКАО) , молекулярные орбитали образуются из атомных путем их линейной комбинации. Пусть электронные орбитали взаимодействующих атомов характеризуются волновыми функциями Ψ 1 , Ψ 2 , Ψ 3 и т.д. Тогда предполагается, что волновая функция Ψ мол , отвечающая молекулярной орбитали, может быть представлена в виде суммы:
Ψ мол. = С 1 Ψ 1 + С 2 Ψ 2 + С 3 Ψ 3 + …. .,
где С 1 , С 2 , С 3 ... некоторые численные коэффициенты. Это уравнение равносильно предположению, что амплитуда молекулярной электронной волны (т.е. молекулярная волновая функция) образуется сложением амплитуд взаимодействующих атомных электронных волн (т. е. сложением атомных волновых функций). При этом, однако, под влиянием силовых полей ядер и электронов соседних атомов волновая функция каждого электрона изменяется по сравнению с исходной волновой функцией этого электрона в изолированном атоме. В методе МОЛКАО эти изменения учитываются введением коэффициентов С 1 , С 2 , С 3 и т.д.
При построении молекулярных орбиталей по методу МОЛКАО должны соблюдаться определенные условия:
1. Комбинируемые атомные орбитали должны быть близкими по энергии, иначе электрону будет энергетически невыгодно находиться на подуровне с более высокой энергией. (1 s и 5 p не взаимодействуют).
2. Необходимо максимальное перекрывание атомных орбиталей, образующих молекулярную орбиталь.
3. Атомные орбитали, образующие молекулярные орбитали, должны обладать одинаковыми свойствами симметрии относительно межъядерной оси молекулы. (p x - электронное облако может комбинироваться только с p x облаком, но не p y и p z ).
Следует также учитывать, что совокупность молекулярных орбиталей молекулы, занятых электронами, представляет ее электронную конфигурацию. Она строится так же как и для атома, на основе принципа наименьшей энергии и принципа Паули.
Для описания электронной конфигурации основного состояния молекулы с 2n или (2n - 1) электронами требуется n молекулярных орбиталей.
Связывающие и разрыхляющие орбитали. Рассмотрим, какой вид будет иметь молекулярная волновая функция Ψ м , образованная в результате взаимодействия волновых функций (Ψ 1 и Ψ 2 ) 1 s орбиталей двух одинаковых атомов. Для этого найдем сумму С 1 Ψ 1 + С 2 Ψ 2 . Поскольку в данном случае атомы одинаковые С 1 = С 2 ; они не будут влиять и на характер волновых функций, поэтому ограничимся нахождением суммы Ψ 1 + Ψ 2 .
Для этого расположим ядра взаимодействующих атомов на том расстоянии друг от друга (r) , на котором они находятся в молекуле. Вид Ψ функций 1 s орбиталей будет следующим:
Ψ мол
Рис. 22. Схема образования связывающей МО
из атомных 1 s - орбиталей
Чтобы найти молекулярную волновую функцию Ψ , сложим величины Ψ 1 и Ψ 2 . В результате получим следующий вид кривой (рис. 22)
Как видно, в пространстве между ядрами значения молекулярной волновой функции Ψ мол. больше, чем значения исходных атомных волновых функций. Но Ψ мол. характеризует вероятность нахождения электрона в соответствующей области пространства, т.е. плотность электронного облака.
Возрастание Ψ мол. – функции в сравнении с Ψ 1 и Ψ 2 означает, что при образовании молекулярной орбитали плотность электронного облака в межъядерном пространстве увеличивается, в результате возникают силы притяжения положительно заряженных ядер к этой области – образуется химическая связь. Поэтому молекулярная орбиталь рассматриваемого типа называется связывающей.
В данном случае область повышенной электронной плотности находится вблизи оси связи, так что образовавшаяся МО относится к σ – типу. В соответствии с этим, связывающая МО , полученная в результате взаимодействия двух атомных 1s – орбиталей обозначается σ св. 1s . Электроны, находящиеся на связывающей МО , называются связывающими электронами.
При взаимодействии двух атомов знаки волновых функций их 1s – орбиталей могут оказаться различными. Такой случай графически можно представить следующим образом:
Ψ мол
Рис. 23. Схема образования разрыхляющей МО
из атомных 1 S – орбиталей
Молекулярная орбиталь (рис. 23), образующаяся при таком взаимодействии, характеризуется уменьшением абсолютной величины волновой функции в межъядерном пространстве по сравнению с ее значением в исходных атомах: на оси связи
появляется даже точка, в которой значение волновой функции, а, следовательно, и ее квадрата, обращается в нуль. Это означает, что в рассматриваемом случае уменьшится и плотность электронного облака в пространстве между атомами. В результате притяжения каждого атомного ядра в направлении к межъядерной области пространства окажется более слабым, чем в противоположном направлении, т.е. возникнут силы, приводящие к взаимному отталкиванию ядер. Здесь, следовательно, химическая связь не возникает; образовавшаяся в этом случае МО называется разрыхляющей (σ разр. 1s ), а находящиеся на ней электроны – разрыхляющими электронами.
Молекулярные орбитали, полученные при сложении и вычитании 1s – атомных орбиталей имеют следующие формы (рис. 24). Взаимодействие, приводящее к образованию связывающей орбитали, сопровождается выделением энергии, поэтому электрон, находящийся на связывающей орбитали, обладает меньшей энергией, чем в исходном атоме.
Рис. 24. Схема образования связывающей и разрыхляющей
молекулярных σ - орбиталей
Образование разрыхляющей орбитали требует затраты энергии. Следовательно, на разрыхляющей орбитали электрон обладает более высокой энергией, чем в исходном атоме.
Двухатомные гомоядерные молекулы элементов первого периода. Образование молекулы водорода H 2 по методу МО представляется следующим образом (рис. 25):
Рис. 25. Энергетическая диаграмма образования
молекулярных орбиталей H 2
Следовательно, вместо двух энергетически равноценных 1 s – орбиталей (исходные атомы водорода) при образовании молекулы H 2 возникают две энергетически неравноценные молекулярные орбитали – связывающая и разрыхляющая.
В этом случае 2 элемента занимают молекулярную орбиталь с более низкой энергией, т.е. σ св 1 s орбиталь.
Реакция образования молекулы H 2 в терминах МО может быть записана:
2 H = H 2 [ (σ св 1 s) 2 ] или
H + H = H 2 [(σ св 1 s) 2 ]
В молекуле H 2 два электрона. Согласно принципу наименьшей энергии и принципу Паули эти два электрона с противоположными спинами также заселяют σ св орбиталь.
Приведенная энергетическая диаграмма молекулярных орбиталей справедлива для двухъядерных образований (элементами первого периода): H 2 + , He 2 + и He 2
В молекулярном дигелии – ионе He 2 + три электрона, два из которых заселяют связывающую, третий – разрыхляющую орбиталь He 2 + [(σ св 1 s) 2 (σ разр 1 s)] (рис. 26):
Ион H 2 + состоит из двух протонов и одного электрона. Естественно, что единственный электрон этого иона должен занимать энергетически наиболее выгодную орбиталь, т.е. σ св 1s . Таким образом, электронная формула иона H 2 + H 2 + [(σ св 1s) " ] (рис. 27):
Рис. 27. Энергетическая диаграмма образования
молекулярных орбиталей H
В системе из двух атомов гелия He 2 четыре электрона; два на связывающей и два на разрыхляющей орбитали.
Энергия, длина и порядок связи. По характеру распределения электронов по молекулярным орбиталям можно оценить энергию и порядок связи. Как уже было показано, нахождение электрона на связывающей орбитали означает, что электронная плотность концентрируется между ядрами, что обуславливает сокращение межъядерного расстояния и упрочения молекулы. Наоборот электрон на разрыхляющей орбитали означает, что электронная плотность концентрируется за ядрами. В этом случае, следовательно, энергия связывания снижается, а межъядерное расстояние увеличивается, как это показано ниже.
В ряду H 2 + - H 2 - He 2 + по мере заполнения связывающей орбитали, энергия диссоциации молекул возрастает, с появлением же электрона на разрыхляющей МО , наоборот, уменьшается, а затем увеличивается.
Молекула гелия существовать не может в невозбужденном состоянии, так как число связывающих и разрыхляющих электронов у нее одинаково.
Согласно методу МО порядок связи (кратность) (n) оценивается полуразностью числа связывающих и разрыхляющих электронов:
a – число электронов на связывающих орбиталях;
b - число электронов на разрыхляющих орбиталях.
или , где А – число атомов в молекуле.
Двухатомные гомоядерные молекулы элементов второго периода. У элементов 2 – го периода кроме 1 s – орбиталей в образовании МО принимают участие 2s -; 2p x - , 2p y и 2p z – орбитали.
Комбинация из 2s – орбиталей, как и в случае атомных 1s – орбиталей, соответствует образованию двух молекулярных σ – орбиталей: σ св 2s и σ разр 2s .
Иная картина наблюдается при комбинации орбиталей p – типа. При комбинации атомных 2p x – орбиталей, которые вытянуты вдоль оси х , возникают молекулярные σ – орбитали: σ св 2p x и σ разр 2p x .
При комбинации 2p y и 2p z атомных орбиталей образуются π св 2p y и π св 2p z , π разр 2p y и π разр 2p z .
Поскольку энергия 2p y и 2p z - орбиталей одинакова и перекрываются они одинаковым способом, возникающие π св 2p y и π св 2p z – орбитали имеют одинаковую энергию и форму; то же самое относится к π разр 2p y и π разр 2p z – орбиталям. Таким образом, молекулярные π – орбитали составляют π св и π разр дважды вырожденные энергетические уровни.
Согласно спектроскопическим данным МО двухатомных молекул элементов конца периода по уровню энергии располагаются в следующем порядке:
σ св 1s < σ разр 1s < σ св 2s < σ разр 2s < σ св 2p x < π св 2p y = π св 2p z < π разр 2p y = π разр 2p z < σ разр 2p x
При энергетической близости 2s и 2p – орбиталей электроны на σ 2s и σ 2p – орбиталях взаимно отталкиваются и потому π св 2p y и π св 2p z - орбитали оказываются энергетически более выгодными, чем σ св 2p x орбиталь. В этом случае порядок заполнения молекулярных орбиталей несколько изменяется и соответствует следующей последовательности:
σ св 1s < σ разр 1s < σ св 2s < σ разр 2s < π св 2p y = π св 2p z < σ св 2p x < π разр 2p y = π разр 2p z < σ разр 2p x
Энергетическое различие 2s и 2p – орбиталей в периоде увеличивается от I группы к VIII . Поэтому приведенная последовательность молекулярных орбиталей характерна для двухатомных молекул элементов начала II – го периода вплоть до N 2 . Так, электронная конфигурация N 2 . в основном (невозбужденном) состоянии имеет вид:
2N = N 2 [(σ св 1s) 2 (σ разр 1s) 2 (σ св 2s) 2 (σ разр 2s) 2 * (π св 2p y) 2 (π св 2p z) 2 (σ св. 2p x) 2 ]
или графически (рис. 28):
АО МО АО
N 1s 2 2s 2 2p 3 N 2 1s 2 2s 2 2p 3
Рис. 28. Энергетическая диаграмма образования
молекулярных орбиталей N 2
Характер распределения электронов по молекулярным орбиталям позволяет объяснить также магнитные свойства молекул. По магнитным свойствам различают парамагнитные и диамагнитные вещества. Парамагнитными являются вещества, у которых имеются непарные электроны, у диамагнитных веществ – все электроны парные.
В таблице приведены сведения об энергии, длине и порядке связи гомоядерных молекул элементов начала и конца 2 – ого периода:
В молекуле кислорода имеется два непарных электрона, поэтому она парамагнитна; молекула фтора непарных электронов не имеет, следовательно, она диамагнитна. Парамагнитны также молекула B 2 и молекулярные ионы H 2 + и He 2 + , а молекулы С 2 , N 2 и H 2 – диамагнитны.
Двухатомные гетероядерные молекулы. Гетероядерные (разноэлементные) двухатомные молекулы описывают методом МОЛКАО , так же как гомоядерные двухатомные молекулы. Однако поскольку речь идет о разных атомах, то энергия атомных орбиталей и их относительный вклад в молекулярные орбитали тоже различны:
Ψ + = С 1 Ψ А + С 2 Ψ B
Ψ - = С 3 Ψ А + С 4 Ψ B
 |
Рис. 29. Энергетическая диаграмма молекулярных орбиталей гетероядерной молекулы АВ
В связывающую орбиталь больший вклад вносит атомная орбиталь более электроотрицательного атома, а в разрыхляющую – орбиталь менее электроотрицательного элемента (рис. 29). Допустим, атом B электроотрицательнее атома A . Тогда С 2 > С 1 , а С 3 > С 4 .
Различие в энергии исходных атомных орбиталей определяет полярность связи. Величина в является мерой ионности,
а величина a – ковалентности связи.
Диаграмма энергетических уровней гетероядерных двухатомных молекул 2 – го периода аналогична диаграмме гомоядерных молекул 2 – го периода. Например, рассмотрим рас-пределение электронов по орбиталям молекулы CO и ионов CN - и NO + .
Молекула CO и ионы CN - , NO + изоэлектронны молекуле N 2 (содержит по 10 валентных электронов), что соответствует следующей электронной конфигурации в невозбужденном состоянии:
 |
(σs св.) 2 (σs разр.) 2 (πу св.) 2 (πz св.) 2 (σх св.) 2
Энергетическая диаграмма уровней молекулы BeH 2 имеет вид: Четыре валентных электрона невозбужденной молекулы BeH 2 располагаются на σ и σ - орбиталях, что описывается формулой (σ ) 2 (σ ) 2 .
Ионная связь
Химическая связь, возникающая за счет перехода электронов от атома к атому, называется ионной, или электрова-
лентной. Электровалентность определяется числом электронов, теряемых или приобретаемых каждым атомам. Причиной возникновения ионной связи является большая разность ЭО взаимодействующих атомов 2,0 и более. Принципиального различия в механизме возникновения ковалентной и ионной связей нет. Эти виды связи отличаются лишь степенью поляризации электронного облака связи, а, следовательно, длинами диполей и величинами дипольных моментов. Чем меньше разность электроотрицательностей атомов, тем более проявляется ковалентная связь и менее - ионная. Даже в таком ’’идеальном” ионном соединении, как фторид франция, ионная связь составляет около 93- 94 % .
Если рассмотреть соединения элементов какого – либо периода с одним и тем же элементом, то по мере передвижения от начала к концу периода преимущественно ионный характер связи меняется на ковалентный. Например, у фторидов элементов 2 – ого периода в ряду LiF, BeF 2 , BF 3 , CF 4 , NF 3 , OF 2 , F 2 ионная связь характерная для фторида лития, постепенно ослабевает и переходит в типично ковалентную связь в молекуле фтора.
Для однотипных молекул, например HF, HCl, HBr, HS (или H 2 O, H 2 S, H 2 Se ), дипольный момент тем больше, чем больше ЭО элементов (ЭО F > ЭО Cl ; ЭО О > ЭO S , Se ).
Образующиеся ионы можно представить в виде заряженных шаров, силовые поля которых равномерно распределяются во всех направлениях пространства (рис. 30). Каждый ион может притягивать к себе ионы противоположного знака по любому направлению. Иначе говоря, ионная связь в отличие от ковалентной характеризуется ненаправленностью .

Рис. 30. Распределение электрических силовых
полей двух разноименных ионов
В отличие от ковалентной связи ионная связь характеризуется еще и ненасыщенностью . Объясняется это тем, что образующиеся ионы способны притягивать большое количество ионов противоположного знака. Число притягивающихся ионов определяется относительными размерами взаимодействующих ионов. Вследствие ненаправленности и ненасыщаемости ионной связи, энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Таким образом, для ионных соединений понятие простых двухионных молекул типа NaCl, CsCl теряет смысл. Ионные соединения в обычных условиях представляют собой кристаллические вещества. Весь кристалл можно рассматривать как гигантскую молекулу, состоящую из ионов Na , Cl и Cs Cl
Лишь в газообразном состоянии ионные соединения существуют в виде неассоциированных молекул типа NaCl и CsCl .
Ионная связь, как было показано выше, не является чисто ионной даже в типичных молекулах (CsF, F 2 F ). Неполное разделение зарядов в ионных соединениях объясняется взаимной поляризацией ионов, т.е. влиянием их друг на друга. Поляризуемость – способность к деформации электронных оболочек в электрическом поле.
Это приводит к деформации электронных оболочек ионов. Наибольшее смещение испытывают при поляризации электроны внешнего слоя, поэтому в первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка. Поляризуемость различных ионов неодинакова
Li + < Na + < K + < Rb + < Cs +
Увеличение R
Точно также поляризуемость галогенов изменяется в следующей последовательности:
F - < Cl - < Br - < I -
Увеличение R иона, увеличение поляризуемости.
Чем меньше заряд иона, тем меньше его поляризуемость. Поляризующая способность ионов, т.е. их способность оказывать деформирующее воздействие на другие ионы зависит от заряда и размера ионов. Чем больше заряд иона и меньше его радиус, тем сильнее создаваемое им электрическое поле, следовательно, тем больше его поляризующая способность. Таким образом, анионы характеризуются (в сравнении с катионами) сильной поляризуемостью и слабой поляризующей способностью.
Рис. 31. Смещение электронного облака аниона
в результате поляризации
Под действием электрических полей каждого иона внешняя электронная оболочка смещается в сторону противоположно заряженного иона. Действие электрических полей смещает и ядра атомов в противоположных направлениях. Под действием электрического поля катиона внешнее электронное облако аниона смещается. Происходит как бы обратный перенос части электронного заряда от аниона к катиону (рис. 31).
Таким образом, в результате поляризации электронные облака катиона и аниона оказываются не полностью разделенными и частично перекрываются, связь из чисто ионной превращается в сильнополярную ковалентную. Следовательно, ионная связь – предельный случай полярной ковалентной связи. Поляризация ионов оказывает заметное влияние на свойства образуемых ими соединений. Поскольку с усилением поляризации возрастает степень ковалентности связи, то это сказывается на диссоциации солей в водных растворах. Так, хлорид BaCl 2 принадлежит к сильным электролитам и в водных растворах практически полностью распадается на ионы, тогда как хлорид ртути HgCl 2 почти не диссоциирует на ионы. Это объясняется сильным поляризующим действием иона Hg 2+ радиус которого (1,1 Аº ) заметно меньше радиуса иона Ba 2+ (1,34 Аº )
Особенно высоким поляризующим действием обладает ион водорода, который может сближаться с анионом до близкого расстояния, внедряясь в его электронную оболочку и вызывая сильную ее деформацию. Так, радиус Cl - равен 1,81 Аº , а расстояние между ядрами атомов хлора и водорода в HCl – 1,27 Аº .
Водородная связь
Общие понятия. Водородная связь – разновидность донорно – акцепторной связи, осуществляющаяся между молекулами различных веществ, в состав которых входит водород. Если молекулу такого вещества обозначить НХ , то взаимодействие за счет водородной связи можно выразить так
Н – Х….. Н – Х….. Н – Х
В качестве х можно взять атомы F, O, N, Cl, S и др. Точечным пунктиром обозначена водородная связь.
В молекулах НХ атом H ковалентно соединен с электроотрицательным элементом, общая электронная пара значительно смещена к электроотрицательному элементу. Водородный атом оказывается протонированным (H + ) и он имеет свободную орбиталь.
Анион электроотрицательного элемента другой молекулы НХ имеет неподеленную пару электронов, за счет которых происходит взаимодействие. Если водородная связь образуется между разными молекулами, то она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной. Образование водородной связи наблюдается в растворах НF, H 2 O (жидк.), NH 3 (жидк.), спиртах, органических кислотах и др.
Энергия и длина водородной связи. Водородная связь отличается от ковалентной меньшей прочностью. Энергия водородной связи невелика и достигает 20 – 42 кДж/моль. Она зависит от электроотрицательности (ЭО) и размеров атомов Х : энергия возрастает с увеличением ЭО и уменьшением их размеров. Длина ковалентной связи заметно меньше длины водородной связи (l св. H) , например, l св. (F - H) = 0, 092 нм , а l св. H (F … H) = 0, 14 нм . У воды l св. (O - H) = 0, 096 нм , а l св. H (O … H) = 0, 177 нм.
или более сложные конфигурации, например у льда, у которого молекулы воды образуют по четыре водородные связи
Соответственно в жидком состоянии молекулы, вступающие в водородные связи, ассоциированы, а в твердом состоянии образуют сложные кристаллические структуры.
При образовании водородных связей существенно изменяются свойства веществ: повышаются температура кипения и плавления, вязкость, теплоты плавления и парообразования. например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления.
Вещества в парообразном состоянии проявляют водородную связь в незначительной степени, т.к. с повышением температуры энергия водородной связи уменьшается.
Задача 241.
Описать электронное строение молекул СО и СN с позиций методов ВС и МО. Какая из молекул характеризуется большей кратностью связи?
Решение:
а) Электронное строение молекул CO и CN с позиции метода ВС.
Электронная конфигурация атома углерода 1s 2 2s 2 2p 2 , атома кислорода 1s 2 2s 2 2p 4 , атома азота 1s 2 2s 2 2p 3 . Электронное строение их валентных орбиталей в невозбуждённом состоянии может быть представлено следующими графическими схемами:
а) атом углерода:
б) атом азота:

При возбуждении атом углерода переходит в состояние 1s 2 2s 1 2p 3 , а электронное строение его валентных орбиталей соответствует схеме:
![]()
Два неспаренных электрона невозбуждённого атома углерода могут участвовать в образовании двух ковалентных связей по обычному механизму с атомом кислорода, имеющем два неспаренных электрона, с образованием молекулы СО. При образовании молекулы CN образуются две ковалентные связи по обычному механизму за счёт двух неспаренных электрона атома углерода и двух неспаренных электронов атома азота. Электронные схемы CO и CN:

б) Электронное строение молекул CO и CN с позиции метода МО.
Энергетические схемы образования молекул а) CO и б) CN:


Из приведённых схем следует, что кратность связи в молекуле СО равна 3 [(6 - 0)/2 = 3], а в молекуле NO – 2,5[(5 – 0)/2 = 2,5]. Следовательно, молекула СО по отношению к молекуле NO характеризуется большей устойчивостью, чем больше кратность связи, тем короче связь. Молекула СN имеет один неспаренный электрон на связывающей орбитали, следовательно, она парамагнитна. Молекула СО не имеет неспаренных электронов на связывающих и разрыхляющих орбиталях, значит, она диамагнитна .
Задача 242.
Рассмотреть с позиций метода МО возможность образования молекул В 2 , F 2 , BF. Какая из этих молекул наиболее устойчива?
Решение:
Энергетические схемы образования молекул а)В 2 , б) F 2 , в) BF:


Из составленных энергетических схем В 2 , F 2 , BF вытекает, что разность между числом связывающих и разрыхляющих электронов соответственно равны 2, 2 и 6, что отвечает кратности связи соответственно 1, 1 и 3. Следовательно, молекула BF характеризуется большей кратностью связи между атомами, она должна быть более прочной, чем у В 2 и F 2 .
Предпосылки возникновения метода
Хронологически метод молекулярных орбиталей появился позже метода валентных связей, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом валентных связей. Рассмотрим некоторые из них.
Основное положение метода валентных связей состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двух-электронных облаков). Но это не всегда так. В ряде случаев в образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н 2+ одноэлектронная связь. Метод валентных связей образование одноэлектронной связи объяснить не может, она противоречит его основному положению.
Метод валентных связей не объясняет также роли неспаренных электронов в молекуле. Молекулы, имеющие неспаренные электроны, парамагнитны, т.е. втягиваются в магнитное поле, так как неспаренный электрон создает постоянный магнитный момент. Если в молекулах нет неспаренных электронов, то они диамагнитны - выталкиваются из магнитного поля. Молекула кислорода парамагнитна, в ней имеется два электрона с параллельной ориентацией спинов, что противоречит методу валентных связей. Необходимо также отметить, что метод валентных связей не смог объяснить ряд свойств комплексных соединений - их цветность и др.
Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей.
Основные положения метода
Согласно методу молекулярных орбиталей электроны в молекулах распределены по молекулярным орбиталям, которые подобно атомным орбиталям характеризуются определенной энергией (энергетическим уровнем) и формой. В отличие от атомных орбиталей молекулярные орбитали охватывают не один атом, а всю молекулу, т.е. являются двух- или многоцентровыми. Если в методе валентных связей атомы молекул сохраняют определенную индивидуальность, то в методе молекулярных орбиталей молекула рассматривается как единая система.
Наиболее широко в методе молекулярных орбиталей используется линейная комбинация атомных орбиталей. При этом соблюдается несколько правил:
Уравнение Шредингера для молекулярной системы должно состоять из члена кинетической энергии и члена потенциальной энергии сразу для всех электронов. Но решение одного уравнения с таким большим количеством переменных (индексы и координаты всех электронов) невозможно, поэтому вводится понятие одноэлектронного приближения .
Одноэлектронное приближение предполагает, что можно рассматривать каждый электрон движущимся в поле ядер и усредненном поле остальных электронов молекулы. Это означает, что каждый i -й электрон в молекуле описывается своей собственной функцией ψ i и имеет свою собственную энергию E i . В соответствии с этим, для каждого электрона в молекуле можно составить свое уравнение Шредингера. Тогда для n электронов необходимо решить n уравнений. Это осуществляется методами матричного исчисления с помощью компьютеров.
При решении уравнения Шредингера для многоцентровой и многоэлектронной системы получаются решения в виде одноэлектронных волновых функций - молекулярных орбиталей, их энергий и электронной энергии всей молекулярной системы как целого.
Линейная комбинация атомных орбиталей
В одноэлектронном приближении метод молекулярных орбиталей описывает каждый электрон своей орбиталью. Как в атоме есть атомные орбитали, так и в молекуле есть молекулярные орбитали. Различие заключается в том, что молекулярные орбитали - многоцентровые.
Рассмотрим электрон, расположенный на молекулярной орбитали ψ i нейтральной молекулы, в тот момент времени, когда он находится вблизи ядра некоторого атома m . В этой области пространства потенциальное поле создается, в основном, ядром атома m и находящимися вблизи электронами. Поскольку молекула в целом нейтральна, притяжение между рассматриваемым электроном и каким-либо другим ядром n приблизительно компенсируется отталкиванием между рассматриваемым электроном и электронами, находящимися вблизи ядра n . Значит, вблизи ядра движение электрона будет приближенно таким же, как и в отсутствие остальных атомов. Поэтому в орбитальном приближении молекулярная орбиталь ψ i вблизи ядра m должна быть похожа на одну из атомных орбиталей этого атома. Поскольку атомная орбиталь имеют существенные значения только вблизи своих ядер, можно приблизительно представить молекулярную орбиталь ψ i в виде линейной комбинации атомных орбиталей отдельных атомов.
Для простейшей молекулярной системы, состоящей из двух ядер атомов водорода, учитывая 1s -атомные орбитали, описывающие движение электрона в атоме Н , молекулярная орбиталь представляется в виде:
Величины c 1i и c 2i - численные коэффициенты, которые и находятся решением уравнения Шредингера . Они показывают вклад каждой атомной орбитали в конкретную молекулярную орбиталь. В общем случае коэффициенты принимают значения, лежащие в интервале от -1 до +1. Если в выражении для конкретной молекулярной орбитали один из коэффициентов преобладает, то это отвечает тому, что электрон, находясь на данной молекулярной орбитали, в основном находится вблизи того ядра и описывается в основном именно той атомной орбиталью, чей коэффициент больше. Если коэффициент перед атомной орбиталью близок к нулю, то это означает, что пребывание электрона в области, описываемой данной атомной орбиталью маловероятно. По физическому смыслу квадраты данных коэффициентов определяют вероятность нахождения электрона в области пространства и энергий, описываемых данной атомной орбиталью.
В методе ЛКАО для образования устойчивой молекулярной орбитали необходимо, чтобы энергии атомных орбиталей были близки друг к другу. Кроме того, нужно, чтобы их симметрия не сильно отличалась. При выполнении этих двух требований коэффициенты должны быть близкими по своим значениям, а это, в свою очередь, обеспечивает максимальное перекрывание электронных облаков. При сложении атомных орбиталей образуется молекулярная орбиталь, энергия которой понижается относительно энергий атомных орбиталей. Такая молекулярная орбиталь называется связывающей . Волновая функция, соответствующая связывающей орбитали, получается в результате сложения волновых функций с одинаковым знаком. Электронная плотность при этом концентрируется между ядрами, и волновая функция принимает положительное значение. При вычитании атомных орбиталей энергия молекулярной орбитали повышается. Эта орбиталь называется разрыхляющей . Электронная плотность в этом случае располагается за ядрами, а между ними равна нулю. Волновая функция в двух образовавшихся электронных облаках имеет противоположные знаки, что хорошо видно из схемы образования связывающей и разрыхляющей орбиталей.
Когда атомная орбиталь одного из атомов вследствие большой разницы в энергии или симметрии не может взаимодействовать с атомной орбиталью другого атома, она переходит в энергетическую схему молекулярных орбиталей молекулы с энергией, соответствующей ей в атоме. Орбиталь этого типа называется несвязывающей .
Классификация орбиталей
Классификация орбиталей на σ или π производится в соответствии с симметрией их электронных облаков. σ -орбиталь имеет такую симметрию электронного облака, при которой поворот ее вокруг оси, соединяющей ядра, на 180° приводит к орбитали, по форме не отличимой от первоначальной. Знак волновой функции при этом не меняется. В случае π -орбитали при повороте ее на 180° знак волновой функции меняется на противоположный. Отсюда следует, что s -электроны атомов при взаимодействии между собой могут образовывать только σ -орбитали, а три (шесть) p -орбитали атома - одну σ- и две π -орбитали, причем σ -орбиталь возникает при взаимодействии р х атомных орбиталей, а π -орбиталь - при взаимодействии р y и р z . Молекулярные π -орбитали повернуты относительно межьядерной оси на 90°.
Для того чтобы отличать связывающие и разрыхляющие орбитали друг от друга, а также их происхождение, принята следующая система обозначений. Связывающая орбиталь обозначается сокращением «св» , располагающимся справа вверху после греческой буквы, обозначающей орбиталь, а разрыхляющая - соответственно «разр» . Принято еще одно обозначение: звездочкой помечаются разрыхляющие орбитали, а без звездочки - связывающие. После обозначения молекулярной орбитали пишется обозначение атомной орбитали, которой молекулярная обязана своим происхождением, например, π разр 2p y . Это означает, что молекулярная орбиталь π -типа, разрыхляющая, образовалась при взаимодействии 2р y - атомных орбиталей.
Положение атомной орбитали на шкале энергий определяется значением энергии ионизации атома, отвечающей удалению электрона, описываемого данной орбиталью, на бесконечно большое расстояние. Такая энергия ионизации называется орбитальной энергией ионизации . Так, для атома кислорода возможны типы ионизации, когда удаляется электрон с 2р - или с 2s -электронной подоболочки.
Положение молекулярной орбитали энергетических диаграммах также определяется на основании квантово-химических расчетов электронной структуры молекул. Для сложных молекул число энергетических уровней молекулярных орбиталей на энергетических диаграммах велико, однако для конкретных химических задач часто важно знать энергии и состав не всех молекулярных орбиталей, а только наиболее «чувствительных» к внешним воздействиям. Такими орбиталями являются молекулярные орбитали, на которых размещены электроны самых высоких энергий. Эти электроны могут легко взаимодействовать с электронами других молекул, удаляться с данной молекулярной орбитали, а молекула будет переходить в ионизированное состояние или видоизменяться вследствие разрушения одних или образования других связей. Такой молекулярной орбиталью является высшая занятая молекулярная орбиталь. Зная число молекулярных орбиталей (равно суммарному числу всех атомных орбиталей) и число электронов, нетрудно определить порядковый номер ВЗМО и, соответственно, из данных расчета - ее энергию и состав. Также наиболее важной для изучения химических задач является низшая свободная молекулярная орбиталь, т.е. следующая по очереди за ВЗМО на шкале энергий, но вакантная молекулярная орбиталь. Важны и другие орбитали, прилегающие по энергии к ВЗМО и НСМО.
Молекулярные орбитали в молекулах, как и атомные орбитали в атомах, характеризуются не только относительной энергией, но и определенной суммарной формой электронного облака. Аналогично тому, как в атомах имеются s -, р -, d -, ... орбитали, самая простая молекулярная орбиталь, обеспечивающая связь между только двумя центрами (двухцентровая молекулярная орбиталь), может быть σ -, π -, δ -, ... типа. Молекулярные орбитали разделяются на типы в зависимости от того, какой симметрией они обладают относительно линии, соединяющей ядра атомов относительно плоскости, проходящей через ядра молекулы и др. Это приводит к тому, что электронное облако молекулярной орбитали различным образом распределяется в пространстве.
| σ -орбитали - это молекулярные орбитали, симметричные относительно вращения вокруг межъядерной оси. Область повышенной электронной плотности σ -молекулярной орбитали распределена вдоль данной оси. Такие молекулярные орбитали могут быть образованны любыми атомными орбиталями атомных орбиталей любой симметрии. На рисунке заливкой помечены участки волновых функций, имеющие отрицательный знак; остальные участки имеют положительный знак. | π -орбитали - это молекулярные орбитали, антисимметричные относительно вращения вокруг межъядерной оси. Область повышенной электронной плотности π -молекулярных орбиталей распределена вне межъядерной оси. Молекулярные орбитали π -симметрии образуются при особом перекрывании р -, d - и f -атомных орбиталей. | δ -орбитали - это молекулярные орбитали, антисимметричные относительно отражения в двух взаимно перпендикулярных плоскостях, проходящих через межъядерную ось. δ -молекулярная орбиталь образуется при особом перекрывании d - и f -атомных орбиталей. Электронное облако данных молекулярных орбиталей распределено, главным образом, вне межъядерной оси. |
Физический смысл метода
Для любой другой системы, включающей k атомных орбиталей, молекулярная орбиталь в приближении метода ЛКАО запишется в общем виде следующим образом:
Для уяснения физического смысла такого подхода вспомним, что волновая функция Ψ соответствует амплитуде волнового процесса, характеризующего состояние электрона. Как известно, при взаимодействии, например, звуковых или электромагнитных волн их амплитуды складываются. Как видно, приведенное уравнение разложения молеклярной орбитали на составляющие атомные орбитали равносильно предположению, что амплитуды молекулярной «электронной волны» (т. е. молекулярная волновая функция) тоже образуются сложением амплитуд взаимодействующих атомных «электронных волн» (т. е. сложением атомных волновых функций). При этом, однако, под влиянием силовых полей ядер и электронов соседних атомов волновая функция каждого атомного электрона изменяется по сравнению с исходной волновой функцией этого электрона в изолированном атоме. В методе ЛКАО эти изменения учитываются путем введения коэффициентов c iμ , где индекс i определяет конкретную молекулярную орбиталь, а индекс cμ - конкретную атомную орбиталь. Так что при нахождении молекулярной волновой функции складываются не исходные, а измененные амплитуды - c iμ ·ψ μ .
Выясним, какой вид будет иметь молекулярная волновая функция Ψ 1 , образованная в результате взаимодействия волновых функций ψ 1 и ψ 2 - 1s -орбиталей двух одинаковых атомов. Для этого найдем сумму c 11 ·ψ 1 + c 12 ·ψ 2 . В данном случае оба рассматриваемых атома одинаковы, так что коэффициенты c 11 и c 12 равны по величине (c 11 = c 12 = c 1 ) и задача сводится к определению суммы c 1 ·(ψ 1 + ψ 2) . Поскольку постоянный коэффициент c 1 не влияет на вид искомой молекулярной волновой функции, а только изменяет ее абсолютные значения, ограничимся нахождением суммы (ψ 1 + ψ 2) . Для этого расположим ядра взаимодействующих атомов на том расстоянии друг от друга (r) , на котором они находятся в молекуле, и изобразим волновые функции 1s -орбиталей этих атомов (рисунок а ).
Чтобы найти молекулярную волновую функцию Ψ 1 , сложим величины ψ 1 и ψ 2 : в результате получится кривая, изображенная на (рисунке б ). Как видно, в пространстве между ядрами значения молекулярной волновой функции Ψ 1 больше, чем значения исходных атомных волновых функций. Но квадрат волновой функции характеризует вероятность нахождения электрона в соответствующей области пространства, т. е. плотность электронного облака. Значит, возрастание Ψ 1 в сравнении с ψ 1 и ψ 2 означает, что при образовании молекулярной орбиталли плотность электронного облака в межъядерном пространстве увеличивается. В результате образуется химическая связь. Поэтому молекулярная орбиталь рассматриваемого типа называется связывающей .
В данном случае область повышенной электронной плотности находится вблизи оси связи, так что образовавшаяся молекулярная орбиталь относится к σ -типу. В соответствии с этим, связывающая молекулярная орбиталь, полученная в результате взаимодействия двух атомных 1s -орбиталей, обозначается σ 1s св .
Электроны, находящиеся на связывающей молекулярной орбитали, называются связывающими электронами .
Рассмотрим другую молекулярную орбиталь Ψ 2 . По причине симметрии системы следует предположить, что коэффициенты перед атомными орбиталями в выражении для молекулярной орбитали Ψ 2 = c 21 ·ψ 1 + c 22 ·ψ 2 должны быть равны по модулю. Но тогда они должны отличаться друг от друга знаком: c 21 = - c 22 = c 2 .
Значит, кроме случая где знаки вкладов обеих волновых функции одинаковы, возможен и случай, когда знаки вкладов 1s -атомных орбиталей различны. В таком случае (рисунок (а) )вклад 1s -атомной орбитали одного атома положителен, а другого - отрицателен. При сложении этих волновых функций получится кривая, показанная на рисунке (б) . Молекулярная орбиталь, образующаяся при подобном взаимодействии, характеризуется уменьщением абсолютной величины волновой функции в межъядерном пространстве по сравнению с ее значением в исходных атомах: на оси связи появляется даже узловая точка, в которой значение волновой функции, а, следовательно, и ее квадрата, обращается в нуль. Это означает, что в рассматриваемом случае уменьшится и плотность электронного облака в пространстве между атомами. В результате притяжение каждого атомного ядра в направлении к межъядерной области пространства окажется более слабым, чем в противоположном направлении, т.е. возникнут силы, приводящие к взаимному отталкиванию ядер. Здесь, следовательно, химическая связь не возникает; образовавшаяся в этом случае молекулярная орбиталь называется разрыхляющей σ 1s * , а находящиеся на ней электроны - разрыхляющими электронами .
Переход электронов с атомных 1s -орбиталей на связывающую молекулярную орбиталь, приводящий к возникновению химической связи, сопровождается выделением энергии. Напротив, переход электронов с атомных 1s -орбиталей на разрыхляющую молекулярную орбиталь требует затраты энергии. Следовательно, энергия электронов на орбитали σ 1s св ниже, а на орбитали σ 1s * выше, чем на атомных 1s -орбиталях. Приближенно можно считать, что при переходе 1s -электрона на связывающую молекулярную орбиталь выделяется столько же энергии, сколько необходимо затратить для его перевода на разрыхляющую молекулярную орбиталь.
Порядок связи
В методе молекулярных орбиталей для характеристики электронной плотности, ответственной за связывание атомов в молекулу вводится величина - порядок связи . Порядок связи, в отличие от кратности связи, может принимать нецелочисленные значения. Порядок связи в двухатомных молекулах принято определять по числу связывающих электронов, участвующих в ее образовании: два связывающих электрона соответствуют простой связи, четыре связывающих электрона - двойной связи и т. д. При этом разрыхляющие электроны компенсируют действие соответствующего числа связывающих электронов. Так, если в молекуле имеются 6 связывающих и 2 разрыхляющих электрона, то избыток числа связывающих электронов над числом разрыхляющих равен четырем, что соответствует образованию двойной связи. Следовательно, с позиции метода молекулярных орбиталей химическую связь в молекуле водорода, образованную двумя связывающими электронами, следует рассматривать как простую связь.
У элементов первого периода валентной орбиталью является 1s -орбиталь. Эти две атомных орбитали образуют две σ -молекулярные орбитали - связывающую и разрыхляющую. Рассмотрим электронное строение молекулярного иона H 2 + . Он имеет один электрон, который будет занимать более энергетически выгодную s -связывающую орбиталь. В соответствии с правилом подсчета кратности связи она будет равна 0,5, а так как в ионе имеется один неспаренный электрон, H 2 + будет обладать парамагнитными свойствами. Электронное строение этого иона запишется по аналогии с электронным строением атома так: σ 1s св . Появление второго электрона на s -связывающей орбитали приведет к энергетической диаграмме, описывающей молекулу водорода, возрастанию кратности связи до единицы и диамагнитным свойствам. Возрастание кратности связи повлечет за собой и увеличение энергии диссоциации молекулы H 2 и более короткому межъядерному расстоянию по сравнению с аналогичной величиной у иона водорода.
Двухатомная молекула Не 2 существовать не будет, так как имеющиеся у двух атомов гелия четыре электрона расположатся на связывающей и разрыхляющей орбиталях, что приводит к нулевой кратности связи. Но в тоже время ион He 2 + будет устойчив и кратность связи в нем равна 0,5. Так же, как и ион водорода, этот ион будет обладать парамагнитными свойствами.
У элементов второго периода появляются еще четыре атомных орбитали: 2s, 2р х, 2р у, 2р z , которые будут принимать участие в образовании молекулярных орбиталей. Различие в энергиях 2s - и 2p -орбиталей велико, и они не будут взаимодействовать между собой с образованием молекулярных орбиталей. Эта разница в энергиях при переходе от первого элемента к последнему будет увеличиваться. В связи с этим обстоятельством электронное строение двухатомных гомоядерных молекул элементов второго периода будет описываться двумя энергетическими диаграммами, отличающимися порядком расположения на них σ св 2p x и π св 2p y,z . При относительной энергетической близости 2s - и 2p -орбиталей, наблюдаемой в начале периода, включая атом азота, электроны, находящиеся на σ разр 2s и σ св 2p x -орбиталях, взаимно отталкиваются. Поэтому π св 2p y - и π св 2p z -орбитали оказываются энергетически более выгодными, чем σ св 2p x -орбиталь. На рисунке представлены обе диаграммы. Так как участие 1s -электронов в образовании химической связи незначительно, их можно не учитывать при электронном описании строения молекул, образованных элементами второго периода.
Второй период системы открывают литий и бериллий, у которых внешний энергетический уровень содержит лишь s -электроны. Для этих элементов схема молекулярных орбиталей ничем не будет отличаться от энергетических диаграмм молекул и ионов водорода и гелия, с той лишь разницей, что у последних она построена из 1s -электронов, а у Li 2 и Ве 2 - из 2s -электронов. 1s -электроны лития и бериллия можно рассматривать как несвязывающие, т.е. принадлежащие отдельным атомам. Здесь будут наблюдаться те же закономерности в изменении порядка связи, энергии диссоциации и магнитных свойств. Ион Li 2 + имеет один неспаренный электрон, расположенный на σ св 2s -орбитали - ион парамагнитен. Появление второго электрона на этой орбитали приведет к увеличению энергии диссоциации молекулы Li 2 и возрастанию кратности связи с 0,5 до 1. Магнитные свойства приобретут диамагнитный характер. Третий s -электрон расположится на σ разр -орбитали, что будет способствовать уменьшению кратности связи до 0,5 и, как следствие этого, понижению энергии диссоциации. Такое электронное строение имеет парамагнитный ион Be 2 + . Молекула Ве 2 , так же как и Hе 2 , существовать не может из-за нулевого порядка связи. У этих молекул число связывающих электронов равно числу разрыхляющих.
Как видно из рисунка, по мере заполнения связывающих орбиталей энергия диссоциации молекул увеличивается, а с появлением электронов на разрыхляющих орбиталях уменьшается. Ряд заканчивается нестабильной молекулой Ne 2 . Из рисунка также видно, что удаление электрона с разрыхляющей орбитали приводит к повышению кратности связи и, как следствие этого, увеличению энергии диссоциации и уменьшению межъядерного расстояния. Ионизация молекулы, сопровождаемая удалением связывающего электрона дает прямо противоположный эффект.
ХИМИЧЕСКАЯ СВЯЗЬ
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ.
Метод молекулярных орбиталей (МО) является наиболее универсальным широко применяемым методом описания природы химической связи. Этот метоп базируется на последних достижениях в области квантовой механики и требует привлечения сложного математического аппарата. В настоящем разделе рассматриваются основные качественные выводы о природе и свойствах химической связи.
3.1. Основные задачи.
Метод МО позволяет описывать важнейшие свойства молекулярных систем:
1. Принципиальную возможность образования молекулярных систем.
2. Насыщаемость химической связи и состав молекул.
3. Энергетическую устойчивость молекул и (соответствующих молекулярных ионов) прочность химической связи.
4. Распределение электронной плотности и полярность химических связей.
5. Донорно-акцепторные свойства молекулярных систем.
3.2. Основные положения метода.
Основные положения метода молекулярных орбиталей заключается в следующем:
1. Все электроны принадлежат молекуле в целом и перемещаются в поле ее ядер и электронов.
2. В пространстве между ядрами создается повышенная электронная плотность вследствие квантово-механического эффекта обменного взаимодействия всех обобществленных (делокализованных) электронов. Отметим, что в действительности основной вклад вносят делокализованные валентные электроны атомов.
3. Образование химической связи рассматривается, как переход электронов с атомных орбиталей на молекулярные обитали, охватывающие все ядра, с выигрышем энергии. Если переход на молекулярные орбитали связан с зажатой энергии, то молекула не образуется.
4. Решение задачи сводится к нахождению возможных МО, распределению на них электронов в соответствии с квантово-механическими принципами (принцип минимума, энергии, запрет Паули, правило Гунда) и заключению по свойствам образующейся (или нет) молекулярной системы.
Молекулярные орбитали получаются при комбинировании атомных орбиталей (АО) отсюда название методом МО ЛКАО (МО-линейная комбинация атомных орбиталей).
Правила описания молекул
Правила нахождения МО из АО и вывод о возможности образования молекул заключаются в следующем:
1. Взаимодействуют между собой только АО наиболее близкие по энергии (обычно с разницей не более 12 эВ) 1 .
Необходимый рассматриваемый набор взаимодействующих АО (базисный набор атомных орбиталей) для s- и p-элементов 2 периода включает валентные 2s- и 2p- АО. Именно такой базис АО позволяет заключить о выигрыше энергии при переходе электронов на МО.
Для s- и p-элементов 3 периода во многих случаях оказывается достаточным ограничиться 3s- и 3p- базисом АО, вследствие относительно большой разницы в энергиях 3p- и 3d- состояния.
2. Число молекулярных орбиталей равно числу атомных орбиталей, из которых они образованы. Причём необходимо, в пространстве между ядрами АО перекрывались и имели одинаковую симметрию относительно оси связи (ось x совпадает с осью связи). Молекулярные орбитали, имеющие более низкую энергию (энергетически более выгодное состояние), чем комбинируемые АО, называются связывающими, а более высокую энергию (энергетически менее выгодное состояние) - разрыхляющими. Если энергия МО равна энергии комбинируемой АО, то такая МО называется несвязывающей.
Например, атомы 2 периода азот и фтор имеют 4 базисных АО: одну 2s- три 2p- АО. Тогда двухатомная молекула, образованная двумя одинаковыми атомами элементов 2 периода (N 2 , F 2) имеет восемь МО. Из них 4 орбитали - типа по симметрии относительно оси связи ( S , P - связывающие и разрыхляющие s * , p * и 4 орбитали - типа по симметрии относительно оси связи ( y и Z - связывающие и разрыхляющие и ).
3. Образование МО и распределение электронов представляется с помощью энергетических диаграмм. Горизонтальные линии по краям диаграмм соответствуют энергии каждой из АО отдельного атома, середине - энергиям соответствующих МО. Энергии базисных АО ns и np - элементов 1,2,3 периодов представлены в таблице 1.
Энергетическая диаграмма для молекулы кислорода О 2 представлена на рисунке 1.
При построении энергетических диаграмм следует учитывать взаимное влияние близких по энергиям МО. Если разница энергий комбинируемых АО данного атома мала (менее 12 эВ) и они имеют сходную симметрию относительно оси связи, например 2s- и 2p - АО от лития до азота, то наблюдается дополнительное, т.е. конфигурационное взаимодействие МО. Такое взаимодействие приводит к тому, что на энергетической диаграмме связывающие
P - МО располагаются выше, чем связывающие - и - МО, например, для двухатомных молекул от Li 2 до N 2 .
4. В соответствии с методом МО молекулярная система может образоваться, если число электронов на связывающих МО превышает число электронов на разрыхляющих МО. Т.е. осуществляется выигрыш в энергии по сравнению с изолированным состоянием частиц. Порядок связи (ПС) в двухатомной частице, определяемый как полуразность числа связывающих и разрыхляющих электронов, должен быть больше нуля. Так, ПС = 2 для молекулы кислорода O 2 .
Наличие в молекулах электронов на несвязывающих МО не изменяет ПС, но приводит к некоторому ослаблению энергии связи за счет усиления межэлектронного отталкивания. Указывает на повышенную реакционную способность молекулы, на тенденцию перехода несвязывающих электронов на связывающие МО.