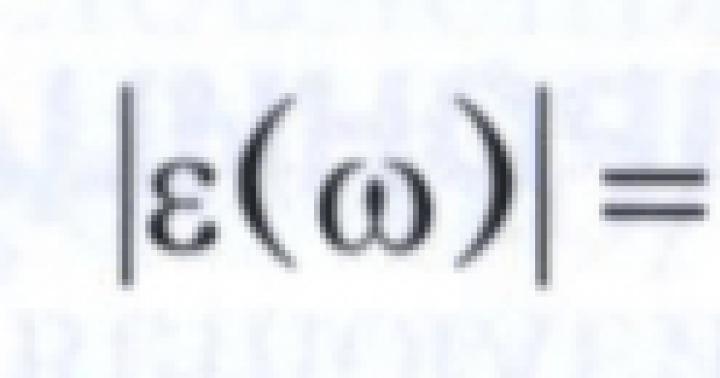Fosfina este un gaz otrăvitor care este incolor și inodor în forma sa pură. Din punct de vedere chimic, este un compus hidrogen volatil al fosforului. În chimie, formula fosfinei este - PH 3. Prin proprietățile sale, are unele asemănări cu amoniacul. Substanța este foarte periculoasă, deoarece are o toxicitate ridicată și o tendință de ardere spontană.
chitanta
Cea mai bine studiată metodă de obținere a fosfinei este reacția de interacțiune a fosforului alb cu o soluție alcalină puternică atunci când este încălzită. În acest caz, fosforul este disproporționat în metafosfat și fosfină. Produsele secundare ale acestei reacții sunt difosfina (P 2 H 4) și hidrogenul, astfel încât randamentul acestei reacții este mic și nu depășește 40%.
Difosfina rezultată în mediul de reacție reacționează cu alcalii, rezultând formarea de fosfină și hidrogen.

Iar hipofosfitul obținut în aceste reacții, atunci când interacționează cu alcalii, trece în fosfat cu eliberarea de hidrogen.
NaH 2 PO 2 + 2NaOH \u003d 2H 2 + Na 3 PO 4
După finalizarea tuturor reacțiilor, ca urmare a interacțiunii alcaline cu fosfor, se formează fosfină, hidrogen și fosfat. Această metodă de producție poate fi realizată și cu oxizi alcalini în loc de alcaline. Această experiență este foarte frumoasă, deoarece difosfina rezultată se aprinde imediat și arde sub formă de scântei, formând ceva asemănător artificiilor.
Când sunt expuse la apă sau acid, fosfurile metalice produc și fosfină.

În timpul descompunerii termice a acidului fosforic sau al reducerii acestuia cu hidrogen, în momentul izolării se formează și fosfină.

Sărurile de fosfoniu, când sunt descompuse sau în reacție cu anumite substanțe, dau fosfină.

Proprietăți fizice
Fosfina este un gaz incolor, inodor. Dar fosfina tehnică (cu unele impurități) poate avea un miros neplăcut caracteristic, care este descris în moduri diferite. Puțin mai greu decât aerul, se lichefiază la -87,42°C și se solidifică la -133,8°C. Astfel de puncte de fierbere și de topire scăzute se datorează legăturilor de hidrogen destul de slabe. Substanța este practic insolubilă în apă, dar în anumite condiții formează hidrați. Să ne dizolvăm bine în etanol și dietil eter. Densitatea fosfinei în condiții normale este de 0,00153 g/cm3.
Proprietăți chimice
După cum sa menționat deja, formula chimică a fosfinei este PH 3. Deși fosfina este similară cu amoniacul, are o serie de diferențe în interacțiunile cu alte substanțe. Aceste caracteristici se datorează faptului că legăturile chimice din fosfină (devine clar din formulă) sunt covalente slab polare. Sunt mai puțin polari decât în amoniac și, prin urmare, sunt mai durabili.
Cu o încălzire puternică (aproximativ 450 ° C) fără acces la oxigen, fosfina se descompune în substanțe simple.
2PH 3 → 2P + 3H 2
La temperaturi peste 100 °C, PH 3 se aprinde spontan prin reacția cu oxigenul atmosferic. Pragul de temperatură poate fi scăzut cu lumină ultravioletă. Din acest motiv, fosfina eliberată în mlaștini se aprinde adesea spontan, provocând apariția așa-numitelor „lumini rătăcitoare”.
PH3 + 2O2 → H3PO4
Dar poate apărea și arderea simplă. Apoi se formează anhidrida fosforică și apa.
2PH 3 + 4O 2 → P 2 O 5 + 3H 2 O
Ca și amoniacul, fosfina poate forma săruri prin reacția cu halogenuri de hidrogen.
PH 3 + HI → PH 4 I
PH 3 + HCl → PH 4 Cl
Pe baza formulei fosfinei, putem spune că fosforul din ea are cea mai scăzută stare de oxidare. Din acest motiv, este un bun agent reducător.
PH 3 + 2I 2 + 2H 2 O → H 3 PO 2 + 4HI
PH 3 + 8HNO 3 → H 3 PO 4 + 8NO 2 + 4H 2 O
Aplicație
Datorită toxicității sale ridicate, fosfina și-a găsit aplicație în fumigație, adică distrugerea diferitelor tipuri de dăunători (insecte, rozătoare) cu ajutorul gazului. Pentru aceste proceduri, există dispozitive speciale - mașini de fumigație, cu ajutorul cărora gazul este pulverizat în interior. De obicei, fosfina sau preparatele pe bază de ea sunt tratate cu depozite de cereale, produse alimentare gata preparate, mobilier, precum și biblioteci, fabrici, vagoane și alte vehicule. Avantajul acestui tratament este că fosfina, chiar și în concentrații mici, pătrunde ușor în locuri greu accesibile și nu interacționează în niciun fel cu metalele, lemnul și țesăturile.
Camera este tratată cu fosfină, se păstrează în stare sigilată timp de 5-7 zile. După aceea, este necesar să se efectueze ventilație timp de cel puțin două zile, altfel este periculos pentru o persoană să fie în ea. După aceea, fosfina nu lasă urme nici măcar pe alimente, cereale și alte bunuri.
Fosfina este folosita si in sinteza anumitor substante, in special a celor organice. De asemenea, din acesta se poate obține fosfor pur chimic, cu utilizarea fosfinei, semiconductorii sunt dopați.
Toxicologie
Fosfina este un compus extrem de toxic. Trece rapid prin tractul respirator și interacționează cu membranele mucoase ale corpului. Acest lucru poate provoca perturbarea sistemului nervos, precum și a metabolismului în general. Semnele de otrăvire pot fi amețeli, greață, vărsături, dureri de cap, oboseală și uneori chiar convulsii. În cazurile severe de plecare, o persoană poate pierde cunoștința sau poate opri respirația și bătăile inimii. Concentrația maximă admisă de fosfină în aer este de 0,1 mg/m 3 . O concentrație de 10 mg / m 3 duce imediat la moarte.
Primul lucru de făcut cu victimele intoxicației cu fosfină este să le scoți la aer curat și să le eliberezi de îmbrăcămintea contaminată. De asemenea, se recomandă udarea victimei cu apă pentru a îndepărta rapid gazul toxic rămas. Tratamentul internat include utilizarea unei măști de oxigen, monitorizarea frecvenței cardiace și a stării ficatului și tratamentul edemului pulmonar. Pacientul trebuie monitorizat cel puțin 2-3 zile, chiar dacă nu există semne vizibile de otrăvire. Unele simptome pot să nu apară decât la câteva zile după expunerea la fosfină.
Ca 3 (PO 4) 2 + 3SiO 2 + 5C = 3CaSiO 3 + 5CO + P 2
Vaporii de fosfor la această temperatură sunt formați aproape în întregime din molecule de P2, care se condensează în molecule de P4 la răcire.
Când vaporii se condensează, se formează fosfor alb (galben)., care constă din molecule P 4 având forma unui tetraedru. Este o substanță foarte reactivă, moale, ceroasă, galben pal, solubilă în disulfură de carbon și benzen. În aer, fosforul se aprinde la 34 ° C. Are capacitatea unică de a străluci în întuneric datorită oxidării lente la cele inferioare. Era fosforul alb care a fost izolat cândva de Brand.
Dacă fosforul alb este încălzit fără acces la aer, acesta se transformă în roșu (a fost obținut pentru prima dată abia în 1847). Nume fosfor roșu se referă la mai multe modificări simultan, care diferă ca densitate și culoare: variază de la portocaliu la roșu închis și chiar violet. Toate soiurile de fosfor roșu sunt insolubile în solvenți organici, în comparație cu fosforul alb, sunt mai puțin reactive (se aprind în aer la t> 200 ° C) și au o structură polimerică: acestea sunt tetraedre P 4 legate între ele în lanțuri nesfârșite. „Fosforul violet” este oarecum diferit de ele, care constă din grupări P 8 și P 9 așezate în structuri tubulare lungi cu o secțiune transversală pentagonală.
La presiune ridicată, fosforul alb este transformat în fosfor negru, construite din hexagoane volumetrice cu atomi de fosfor la vârfuri, conectate între ele în straturi. Pentru prima dată această transformare a fost realizată în 1934 de către fizicianul american Percy Williams Bridgman. Structura fosforului negru seamănă cu grafitul, cu singura diferență că straturile formate din atomi de fosfor nu sunt plate, ci „ondulate”. Fosforul negru este cea mai puțin activă modificare a fosforului. Când este încălzit fără acces la aer, acesta, ca și roșu, trece în vapori, din care se condensează fosforul alb.
Fosforul alb este foarte toxic: doza letală este de aproximativ 0,1 g. Din cauza pericolului de autoaprindere în aer, se depozitează sub un strat de apă. Fosforul roșu și negru sunt mai puțin toxici, deoarece nu sunt volatili și practic insolubili în apă.

Proprietăți chimice
Cel mai activ din punct de vedere chimic este fosforul alb (pentru simplitate, în ecuațiile reacțiilor care implică fosfor alb, ele sunt scrise ca P și nu P4, mai ales că reacții similare sunt posibile cu participarea fosforului roșu, a cărui compoziție moleculară este nedeterminat). Fosforul se combină direct cu multe substanțe simple și complexe. În reacțiile chimice, fosforul, precum , poate fi atât un agent oxidant, cât și un agent reducător.
Cum agent oxidant fosforul interacționează cu multe pentru a forma fosfuri, de exemplu:
2P + 3Ca = Ca 3 P 2
P + 3Na = Na 3 P
Vă rugăm să rețineți că fosforul practic nu se combină direct cu fosforul.
Cum agent de reducere fosforul interacționează cu halogenii, sulful (adică cu mai multe nemetale electronegative). În acest caz, în funcție de condițiile de reacție, se pot forma atât compuși cu fosfor (III), cât și compuși cu fosfor (V).
a) cu oxidare lentă sau cu lipsă de oxigen, fosforul se oxidează la oxid de fosfor (III) sau anhidridă de fosfor P 2 O 3:
4P + 3O 2 \u003d 2P 2 O 3
Când fosforul este ars în exces (sau aer), se formează oxid de fosfor (V) sau anhidridă fosforică P 2 O 5:
4P + 5O 2 \u003d 2P 2 O 5
b) în funcție de raportul de reactivi, interacțiunea fosforului cu halogenii și sulf formează, respectiv, halogenuri și sulfuri de fosfor tri- și pentavalent; De exemplu:
2P + 5Cl 2 (ex.) \u003d 2PCl 5
2P + 3Cl2 (insuficient) = 2PCl3
2P + 5S(e) = P2S5
2P + 3S (insuficient) = P 2 S 3
Trebuie remarcat faptul că fosforul formează doar compusul PI3 cu iod.
Fosforul joacă rolul de agent reducător în reacțiile cu acizii oxidanți:
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO
- cu acid azotic concentrat:
P + 5HNO 3 \u003d H 3 PO 4 + 5NO 2 + H 2 O
- cu acid sulfuric concentrat:
2P + 5H 2 SO 4 \u003d 2H 3 PO 4 + 5SO 2 + 2H 2 O
Fosforul nu interacționează cu alți acizi.
Când este încălzit cu soluții apoase, fosforul suferă o disproporție, de exemplu:
4P + 3KOH + 3H 2 O \u003d PH 3 + 3KH 2 PO 2
8P + 3Ba(OH) 2 + 6H 2 O = 2PH 3 + 3Ba(H 2 PO 2) 2
Pe lângă fosfina PH 3, în urma acestor reacții, se formează săruri ale acidului hipofosforic H 3 PO 2 - hipofosfiți, în care fosforul are o stare de oxidare caracteristică de +1.
Utilizarea fosforului
Cea mai mare parte a fosforului produs în lume este cheltuită pentru producția de acid fosforic, din care se obțin îngrășăminte și alte produse. Fosforul roșu este folosit la fabricarea chibriturilor, este conținut în masă, care se aplică pe cutia de chibrituri.
fosfină
Cel mai cunoscut compus hidrogen al fosforului este fosfina PH 3 . Fosfina este un gaz incolor cu miros de usturoi și este foarte toxic. Foarte solubil în solvenți organici. Spre deosebire de amoniac, este puțin solubil în apă. Fosfina nu are valoare practică.
chitanta
Mai sus a fost considerată o metodă de obținere a fosfinei prin interacțiunea fosforului cu soluțiile apoase. O altă modalitate este acțiunea acidului clorhidric asupra fosfurilor metalice, de exemplu:
Zn 3 P 2 + 6HCl \u003d 2PH 3 + 3ZnCl 2
Proprietăți chimice
- Acid - proprietăți de bază
Fiind puțin solubilă în apă, fosfina formează cu ea un hidrat instabil, care prezintă proprietăți de bază foarte slabe:
PH 3 + H 2 O ⇄ PH 3 ∙H 2 O ⇄ PH 4 + + OH -
Sărurile de fosfoniu se formează numai cu:
PH3 + HCI = PH4CI
PH3 + HCIO4 = PH4Cl04
- Proprietăți redox
Lista completă a rezumatelor poate fi vizualizată
*În imaginea de înregistrare este o fotografie cu fosfor alb
Formula fosfină …………………………………………………………………… pH 3
Greutatea moleculară …………………………………………………………………… 34.04
Culoare și aspect ............................................................. ........Gaz incolor.
Punct de topire ............................................... - 133,5 °C.
Temperatura de fierbere.............................................................. .... -87,7°С.
Presiunea de evaporare ...............40 mmHg Artă. la - 129,4°C.
Solubilitate în apă ........................26% în volum la 17°C.
Densitatea ......................... 1,18 (0°C, 760 mmHg) (Aer-1).
Punct de aprindere ................................................ .............. .....100°С.
Limita inferioară de explozie ........... 1,79-1,89% din volum;
Apariția unui miros la ............................................... ........ ...... 1,3 - 2,6 ppm.
La concentrații relativ mari, fosfina este explozivă.
Limita inferioară de inflamabilitate a concentrației (LEL) - 1,79-1,89%
în volum sau ………………………………..26,15-27,60 g/m3, sau 17000-18900 ml/m3.
Căldura latentă de vaporizare a fosfinei este egală cu …………………………………102,6 cal/g.
Solubilitatea în apă este de 0,52 g/l la o temperatură de 20 0 C și o presiune de 34,2 kgf/cm2.
fosfină
- un gaz extrem de toxic, incolor, care este de 1,5 ori mai greu decât aerul, prin urmare, atunci când este aplicat, pătrunde cu ușurință în toate crăpăturile și locurile greu accesibile din încăperi și distruge eficient ouăle, larvele, pupele și insectele adulte.
Puțin solubil în apă, nu reacționează cu ea. Solubil în benzen, dietil eter, disulfură de carbon. Fosfina este foarte toxică, acționează asupra sistemului nervos, perturbă metabolismul. MAC = 0,1 mg/m³. Mirosul se simte la o concentrație de 2-4 mg/m³, inhalarea prelungită la o concentrație de 10 mg/m³ este fatală.
Utilizarea fosfinei Când se efectuează fumigări cu fosfină, se folosesc preparate anorganice pe bază de fosfuri de aluminiu și magneziu. Obiectele și tehnologia utilizării preparatelor pe bază de fosfură de magneziu sunt identice cu preparatele pe bază de fosfură de aluminiu. Admiterea persoanelor și încărcarea depozitelor este permisă după ventilarea completă și când conținutul de fosfină în aerul zonei de lucru nu este mai mare decât MPC (0,1 mg/m³). Vânzarea produselor se realizează cu un reziduu de fosfină nu mai mare decât LMR (0,1 mg/kg pentru cereale, 0,01 mg/kg pentru produsele de prelucrare a cerealelor).
Fosfină gazoasă Este o otravă puternică pentru oameni și alte animale cu sânge cald. Intoxicația acută cu fosfină apare atunci când concentrația acesteia în aer este de 568 mg/m3. Gazul fosfin este foarte toxic pentru insectele dăunătoare din stocurile de cereale. Când lucrați cu el, este de dorit să aveți o idee despre metoda și mecanismul de acțiune asupra organismelor dăunătoare. Concentrația maximă admisă (MAC) de fosfină în aerul zonei de lucru este de 0,1 mg/m3. Totuși, mirosul de gaz începe să se simtă la concentrații mai mici (aproximativ 0,03 mg/m3). Nivelul maxim admisibil (LMR) de fosfină în cereale este de 0,01 mg/kg; reziduurile de fosfină în produsele din cereale nu sunt permise. Cerealele și produsele prelucrării lor pot fi utilizate în scopuri alimentare numai dacă cantitățile reziduale de fosfină din acestea nu depășesc LMR.
Fosfină gazoasă este slab absorbit de cereale și produse din cereale, prin urmare este ușor degazat. În ratele de consum recomandate pentru dezinfestare, nu modifică calitatea boabelor și nu îi afectează calitățile semințelor. A fost folosit pentru prima dată în 1934 pentru fumigația produselor din cereale. În prezent, din cauza interzicerii utilizării bromurii de metil în scopuri de fumigație, fosfina este principalul fumigant pentru combaterea dăunătorilor.
Tutor de chimie
Continuare. Vedea în nr. 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19, 21/2008;
1, 3, 10, 11/2009
ACTIVITATEA 30
clasa a 10-a(primul an de studiu)
Fosforul și compușii săi
1. Poziția în tabelul lui D.I. Mendeleev, structura atomului.
2. Scurtă istorie a descoperirii și originea numelui.
3. Proprietăți fizice.
4. Proprietăți chimice.
5. A fi în natură.
6. Principalele metode de obținere
7. Cei mai importanți compuși ai fosforului.
Fosforul se află în subgrupul principal al grupului V al sistemului periodic al lui D.I. Mendeleev. Formula sa electronică este 1 s 2 2s 2 p 6 3s 2 p 3 este R-element. Stări de oxidare caracteristice ale fosforului în compuși –3, +3, +5; cea mai stabilă este starea de oxidare +5. În compuși, fosforul poate fi inclus atât în compoziția cationilor, cât și în compoziția anionilor, de exemplu:

Fosforul și-a primit numele de la proprietatea fosforului alb de a străluci în întuneric. Cuvântul grecesc se traduce prin „aducerea de lumină”. Fosforul datorează acest nume descoperitorului său, alchimistul Brand, care, fascinat de strălucirea fosforului alb, a ajuns la concluzia că a primit piatra filosofală.
Fosforul poate exista sub forma mai multor modificări alotrope, dintre care cele mai stabile sunt fosforul alb, roșu și negru.
Moleculă fosfor alb (cel mai activ alotrop) are o rețea cristalină moleculară, în nodurile căreia se găsesc molecule P 4 cu patru atomice cu o structură tetraedrică.
Fosforul alb este moale, ca ceara, se topește și fierbe fără descompunere, are un miros de usturoi. În aer, fosforul alb se oxidează rapid (luminează verzui), este posibilă autoaprinderea fosforului alb fin dispersat. Este insolubil în apă (depozitat sub un strat de apă), dar ușor solubil în solvenți organici. Otrăvitoare (chiar și în doze mici, MPC = 0,03 mg/m 3). Are o activitate chimică foarte mare. Când este încălzit fără acces la aer la 250-300 ° C, se transformă în fosfor roșu.
fosfor roșu este un polimer anorganic; macromoleculele P n poate avea atât structuri ciclice cât și aciclice. Diferă foarte mult de fosforul alb prin proprietățile sale: nu este otrăvitor, nu strălucește în întuneric, nu se dizolvă în disulfură de carbon și alți solvenți organici și nu are activitate chimică ridicată. La temperatura camerei, se transformă încet în fosfor alb; când este încălzit la 200 ° C sub presiune, se transformă în fosfor negru.
fosfor negru arata ca grafitul. După structură, este un polimer anorganic, ale cărui molecule au o structură stratificată. Semiconductor. Nu otrăvitoare. Activitatea chimică este mult mai mică decât cea a fosforului alb. Rezistent la aer. Când este încălzit, se transformă în fosfor roșu.
Proprietăți chimice
Cel mai activ din punct de vedere chimic este fosforul alb (dar în practică preferă să lucreze cu fosforul roșu). Poate prezenta proprietățile atât ale unui agent oxidant, cât și ale unui agent reducător în reacții, de exemplu:
4P + 3O 2 2P 2 O 3,
4P + 5O 2 2P 2 O 5.
Metale (+/-)*:
3Ca + 2P Ca 3 P 2 ,
3Na + P Na 3 P,
Cu + P nu reacționează.
Nemetale (+):
![]()
2P + 3I 2PI 3,
6P + 5N 2 2P 2 N 5 .

Oxizi bazici (-).
Oxizi acizi (-).
Alcaline (+):
Acizi (nu agenți oxidanți) (-).
Acizi oxidanți (+):
3P (cr.) + 5HNO 3 (razb.) + 2H 2 O \u003d 3H 3 PO 4 + 5NO,
P (cr.) + 5HNO3 (conc.) H3PO4 + 5NO2 + H2O,
2P (cr.) + H2S04 (conc.) 2H3PO4 + 5SO2 + 2H2O.
Săruri (-)**.
În natură, fosforul se găsește sub formă de compuși (săruri), dintre care cei mai importanți sunt fosforitul (Ca 3 (PO 4) 2), clorapatita (Ca 3 (PO 4) 2 CaCl 2) și fluorapatita (Ca 3 (PO 4) 4) 2 CaF 2). Fosfatul de calciu se găsește în oasele tuturor vertebratelor, determinând rezistența acestora.
Fosforul se obține în cuptoarele electrice prin topirea fosfatului de calciu, nisipului și cărbunelui fără acces la aer:
Ca 3 (PO 4 ) 2 + 3SiO 2 + 5C 2P + 5CO + 3CaSiO 3.
Cei mai importanți compuși ai fosforului sunt: fosfina, oxidul de fosfor(III), oxidul de fosfor(V), acizii fosforici.
F o s f i n
Acest compus hidrogen al fosforului, un gaz incolor cu miros de usturoi-pește, este foarte toxic. Să ne dizolvăm prost în apă, dar ne vom dizolva bine în solvenți organici. Mult mai puțin stabil decât amoniacul, dar un agent reducător mai puternic. Nu are valoare practică.
Pentru a obține fosfină, de obicei nu se utilizează o reacție de sinteză directă din substanțe simple; Cea mai comună modalitate de a obține fosfină este hidroliza fosfurilor:
Ca 3 P 2 + 6HOH \u003d 3Ca (OH) 2 + 2PH 3.
În plus, fosfina poate fi obținută printr-o reacție de disproporționare între soluțiile de fosfor și alcaline:
4P + 3KOH + 3H 2 O PH 3 + KPO 2 H 2,
sau din săruri de fosfoniu:
PH 4 I PH 3 + HI,
PH4I + NaOH PH3 + NaI + H2O.
Este recomandabil să luați în considerare proprietățile chimice ale fosfinei din două părți.
Proprietăți acido-bazice. Fosfina formează un hidrat instabil cu apa, care prezintă proprietăți de bază foarte slabe:
PH 3 + H 2 O PH 3 H 2 O (PH 4 OH),
PH 3 + HCI PH 4 Cl,
2PH3 + H2SO4 (PH4)2SO4.
proprietăți redox. Fosfina este un agent reducător puternic:
2PH 3 + 4O 2 P 2 O 5 + 3H 2 O,
PH 3 + 8AgNO 3 + 4H 2 O \u003d H 3 PO 4 + 8Ag + 8HNO 3.
O x i d f o s f o r a (III)
Oxid P 2 O 3 (formulă adevărată - P 4 O 6) este o substanță cristalină albă, un oxid acid tipic. Când interacționează cu apa la rece, formează acid fosforic (tărie medie):
P 2 O 3 + 3H 2 O \u003d 2H 3 PO 3

Deoarece acidul fosforic este dibazic, interacțiunea trioxidului de fosfor cu alcalii formează două tipuri de săruri - hidrofosfiți și dihidrofosfiți.
De exemplu:
P 2 O 3 + 4NaOH \u003d 2Na 2 HPO 3 + H 2 O,
P 2 O 3 + 2NaOH + H 2 O \u003d 2NaH 2 PO 3.
Dioxidul de fosfor P 2 O 3 este oxidat de oxigenul atmosferic la pentoxid:
P 2 O 3 + O 2 P 2 O 5 .
Trioxidul de fosfor și acidul fosforic sunt agenți reducători destul de puternici. Oxidul de fosfor(III) se obține prin oxidarea lentă a fosforului în absența oxigenului:
4P + 3O 2 2P 2 O 3 .
Oxid fosfor(V) și acizi fosforici
pentoxid de fosfor P 2 O 5 (formulă adevărată - P 4 O 10) este o substanță cristalină higroscopică albă. În stare solidă și gazoasă, molecula există sub formă de dimer, iar la temperaturi ridicate se monomerizează. Un oxid acid tipic. Este foarte solubil în apă, formând o serie de acizi fosforici:
metafosforic:
P 2 O 5 + H 2 O \u003d 2HPO 3

pirofosforic (difosforic):
P 2 O 5 + 2H 2 O \u003d H 4 P 2 O 7

ortofosforic (fosforic):
P 2 O 5 + 3H 2 O \u003d 2H 3 PO 4

Pentoxidul de fosfor prezintă toate proprietățile caracteristice oxizilor acizi, de exemplu:
P 2 O 5 + 3H 2 O \u003d 2H 3 PO 4,
P2O5 + 3CaO2Ca3 (P04)2;
poate forma trei tipuri de săruri:

Proprietățile oxidante nu sunt tipice pentru acesta, deoarece. Starea de oxidare +5 este foarte stabilă pentru fosfor. Pentoxidul de fosfor se obține prin arderea fosforului într-o cantitate suficientă de oxigen:
4P + 5O 2 2P 2 O 5 .
Acid ortofosforic H 3 RO 4 este o substanță cristalină incoloră, foarte solubilă în apă, higroscopică. Este un acid tribazic de putere medie; nu are proprietăți oxidante pronunțate. Prezintă toate proprietățile chimice caracteristice acizilor, formează trei tipuri de săruri (fosfați, hidrofosfați și dihidrofosfați):
2H 3 PO 4 + 3Ca = Ca 3 (PO 4) 2 + 3H 2,
H3PO4 + Cu,
2H 3 PO 4 + 3CaO = Ca 3 (PO 4) 2 + 3H 2 O,

2H 3 PO 4 + K 2 CO 3 \u003d 2KH 2 PO 4 + CO 2 + H 2 O.
În industrie, acidul fosforic se obține prin extracție:
Ca 3 (PO 4) 2 + 3H 2 SO 4 \u003d 2H 3 PO 4 + 3CaSO 4,
precum si metoda termica:
Ca 3 (PO 4) 2 + 3SiO 2 + 5C 3СaSiO 3 + 2P + 5CO,
4P + 5O 2 2P 2 O 5,
P 2 O 5 + 3H 2 O \u003d 2H 3 PO 4.
Metodele de laborator pentru obținerea acidului fosforic includ acțiunea acidului azotic diluat asupra fosforului:
3P (cr.) + 5HNO 3 (razb.) + 2H 2 O \u003d 3H 3 PO 4 + 5NO,
interacțiunea acidului metafosforic cu apa la încălzire:
HPO3 + H20H3P04.
În corpul uman, acidul ortofosforic se formează prin hidroliza adenozin trifosfatului (ATP):
ATP ADP + H3PO4.
Reacția calitativă la ionul fosfat este reacția cu cationul de argint; se formează un precipitat galben, insolubil în medii ușor acide:
3Ag + + \u003d Ag 3 PO 4,
3AgNO 3 + K 3 PO 4 = Ag 3 PO 4 + 3KNO 3.
În plus față de acizii fosforici de mai sus (conțin fosfor în starea de oxidare +5), mulți alți acizi care conțin oxigen sunt cunoscuți pentru fosfor. Iată câțiva dintre cei mai importanți reprezentanți.
Fosfor(HPO2H2) este un acid monobazic de putere medie. Al doilea nume este fosfină:

Sărurile acestui acid sunt numite hipofosfiți sau fosfiți, de exemplu KPO2H2.
Fosfor(H 3 RO 3) - acid dibazic de tărie medie, puțin mai slab decât hipofosforul. Are, de asemenea, un al doilea nume - fosfonic:

Sărurile sale sunt numite fosfiți sau fosfonați, de exemplu K 2 PO 3 H.
Difosforic (pirofosforic)(H 4 P 2 O 7) - un acid tetrabazic de rezistență medie, puțin mai puternic decât ortofosforic:

Sărurile sunt difosfați, de exemplu K4P2O7.
Test pe tema „Fosfor și compușii săi”
1. Eliminați elementul „extra” din cele enumerate conform principiului posibilității de a forma modificări alotropice:
a) oxigen; b) azot;
c) fosfor; d) sulf.
2. Când interacționează 42,6 g de anhidridă fosforică și 400 g de soluție de hidroxid de sodiu 15%, se formează următoarele:
a) fosfat de sodiu;
b) fosfat acid de sodiu;
c) un amestec de fosfat şi hidrogenofosfat de sodiu;
d) un amestec de hidrogenofosfat de sodiu și dihidrogenofosfat.
3. Suma coeficienților din ecuația pentru disocierea electrolitică a fosfatului de potasiu este:
a) 5; b) 3; la 4; d) 8.
4. Numărul de electroni din nivelul exterior al atomului de fosfor:
a) 2; b) 3; la 5; d) 15.
5. Fosforul, obținut din 33 g de fosfat de calciu tehnic, a fost ars în oxigen. Oxidul de fosfor(V) rezultat a reacţionat cu 200 ml de soluţie de hidroxid de sodiu 10% (densitate 1,2 g/ml) pentru a forma o sare medie. Masa de impurități din proba tehnică de fosfat de calciu (în g) este:
a) 3,5; b) 1,5; în 2; d) 4.8.
6. Numărul de legături - într-o moleculă de acid pirofosforic:
a) 2; b) 12; c) 14; d) 10.
7. Numărul de atomi de hidrogen conținuți în 4,48 L (N.O.) de fosfină este:
a) 1,2 10 23; b) 0,6 10 23;
c) 6,02 10 23; d) 3,6 10 23 .
8. La o temperatură de 30 ° C, o anumită reacție are loc în 15 s, iar la 0 ° C - în 2 minute. Coeficientul Van't Hoff pentru această reacție:
a) 2,4; b) 2; c) 1,8; d) 3.
9. Acidul ortofosforic poate reacționa cu următoarele substanțe:
a) oxid de cupru(II); b) hidroxid de potasiu;
c) acid azotic; d) zinc.
10. Suma coeficienților în reacția dintre fosfor și sarea lui Bertolet este:
a) 9; b) 6; c) 19; d) o astfel de reacție este imposibilă.
Cheia testului
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| b | în | A | în | în | b | G | b | a, b, d | în |
Sarcini și exerciții pentru fosfor și compușii săi
Lanțuri de rotații:
1. Fosfor -> pentoxid de fosfor -> acid fosforic -> fosfat de calciu ® acid fosforic.
2. Fosfat de calciu -> fosfor -> fosfura de calciu -> fosfina -> pentoxid de fosfor -> acid fosforic -> fosfat dihidrogen de calciu.
3. Fosfat de calciu -> A -> B -> C -> D -> E -> fosfat de calciu. Toate substanțele conțin fosfor, în schemă există trei OVR-uri la rând.
4. Fosfor -> pentoxid de fosfor -> fosfat de calciu -> fosfor -> fosfină -> acid fosforic -> fosfat dihidrogen de calciu.
5. Fosfură de calciu (+ soluție de acid clorhidric) -> A (+ oxigen) -> B (+ hidroxid de sodiu, deficit) -> C (+ hidroxid de sodiu, exces) -> D (+ hidroxid de calciu) -> E.
| Un nivel |
1. Cu arderea completă a 6,8 g de substanță, s-au obținut 14,2 g pentoxid de fosfor și 5,4 g apă. S-au adăugat 37 ml de soluţie de hidroxid de sodiu 32% (densitate 1,35 g/ml) la produsele de reacţie obţinute. Setați formula substanței de pornire și determinați concentrația soluției rezultate.
Decizie
Ecuația reacției:
![]()
(P205) = 0,1 mol, (H20) = 0,3 mol.
(P) = 0,2 mol, (H) = 0,6 mol.
m(P) = 6,2 g, m(H) = 0,6 g.
m= 6,8 g.
(P): (H) = 0,2: 0,6 = 1: 3.
Prin urmare, formula substanței de pornire este PH 3, iar ecuația reacției:

apoi se formează acid fosforic:
(H 3 PO 4) \u003d 2 (P 2 O 5) \u003d 0,2 mol.
Cu alcalii, acidul fosforic poate reacționa după cum urmează:

Să determinăm cantitatea de substanță NaOH în funcție de starea problemei:

(H3PO4): (NaOH) \u003d 0,2: 0,4 \u003d 1: 2,
deci are loc reacția 2.
(Na2HP04) \u003d (H3PO4) \u003d 0,2 mol;
m(Na2HPO4) = M(Na2HP04) (Na2HP04) = 142 0,2 = 28,4 g;
m(r-ra) = m(P2O5) + m(H20)+ m(p-ra NaOH) \u003d 14,2 + 5,4 + 37 1,35 \u003d 69,55 g.
(Na2HPO4) = m(Na2HPO4)/ m(soluție) = 28,4 / 69,55 = 0,4083, sau 40,83%.
Răspuns. PH3; (Na2HP04) = 40,83%.
2. Cu electroliza completă a 1 kg de soluție de sulfat de fier (II), 56 g de metal au fost eliberate pe catod. Ce masă de fosfor poate reacționa cu substanța eliberată la anod și care va fi compoziția sării dacă produsul de reacție rezultat este dizolvat în 87,24 ml de soluție de hidroxid de sodiu 28% (densitatea soluției 1,31 g/ml)?
Răspuns. 12,4 g fosfor; fosfat acid de sodiu.
3. 20 g dintr-un amestec de sulfat de bariu, fosfat de calciu, carbonat de calciu și fosfat de sodiu au fost dizolvate în apă. Masa părții insolubile a fost de 18 g. Sub acțiunea acidului clorhidric asupra acesteia s-au eliberat 2,24 l de gaz (N.O.), iar masa reziduului insolubil a fost de 3 g. Se determină compoziția amestecului inițial de săruri în masă .
Răspuns. Na3P04 - 2 g; BaC03 - 3 g;
CaCO3 - 10 g; Ca3 (PO4) 3 - 5 g.
4. Câte kg de fosfor se pot obține dintr-o tonă de fosforit care conține 40% impurități? Care este volumul la n.o. luați fosfină derivată din acest fosfor?
Răspuns. 120 kg P; 86,7 m 3 PH 3 .
5. 40 g dintr-un mineral care conține 77,5% fosfat de calciu au fost amestecate cu un exces de nisip și cărbune și încălzite fără aer într-un cuptor electric. Substanța simplă obținută a fost dizolvată în 140 g de acid azotic 90%. Determinați masa de hidroxid de sodiu necesară pentru a neutraliza complet produsul de oxidare al unei substanțe simple.
Răspuns. 24 g NaOH.
| Nivelul B |
1. Pentru neutralizarea completă a soluției obținute prin hidroliza a 1,23 g de halogenură de fosfor au fost necesari 35 ml de soluție de hidroxid de potasiu 2M. Determinați formula pentru halogenură.
Răspuns. Trifluorura de fosfor.
2. O probă de etanol anhidru care conține 0,5% oxid de fosfor (V) ca impuritate a fost arsă în oxigen suficient. Gazele rezultate au fost separate, iar soluția rezultată a fost încălzită până la încetarea degajării gazului, după care i s-a adăugat o soluție de hidroxid de potasiu 0,5% egală în masă. Determinați fracțiile de masă ale substanțelor din soluția rezultată.
Răspuns. K2HP04 - 0,261%;
KH2PO4 - 0,204%.
3. La 2 g dintr-un amestec de hidrofosfat și dihidrogenofosfat de potasiu, în care fracția de masă a fosforului este de 20%, s-au adăugat 20 g de soluție 2% de acid fosforic. Calculați fracțiile de masă ale substanțelor din soluția rezultată.
Răspuns. KH2P04 - 9,03%;
K2HP04 (restul) - 1,87%.
4. La tratarea cu apă a unui amestec de hidrură și fosfură a unui metal alcalin cu fracțiuni de masă egale, s-a format un amestec de gaz cu o densitate de azot de 0,2926. Determinați ce metal a fost inclus în compuși.
Răspuns. Sodiu.
5. S-au calcinat 50 g dintr-un amestec de fosfat de calciu și carbonați de calciu și amoniu, rezultând 25,2 g de reziduu solid, la care s-a adăugat apă și apoi s-a trecut un exces de dioxid de carbon. Masa reziduului nedizolvat a fost de 14 g. Se determină masa de carbonat de amoniu din amestecul inițial.
Decizie
Când amestecul este calcinat, au loc următoarele procese:
1) Ca3 (PO4)2;
2) ![]()
3) (NH4)2CO32NH3 + CO2 + H2O.
În reziduul solid - Ca 3 (PO 4) 2 și CaO.
După adăugarea apei:
4) Ca3(P04)2 + H20;
5) CaO + H2O \u003d Ca (OH) 2.
După trecerea dioxidului de carbon:
6) Ca (OH) 2 + H 2 O + CO 2 \u003d Ca (HCO 3) 2.
Reziduul nedizolvat este Ca3(PO4)2, prin urmare, m(Ca3(P04)2) = 14 g.
Aflați masa CaO:
m(CaO) \u003d 25,2 - 14 \u003d 11,2 g.
(CaO) \u003d 11,2 / 56 \u003d 0,2 mol,
(CaCO 3) \u003d (CaO) \u003d 0,2 mol,
m(CaCO 3) \u003d 0,2 100 \u003d 20 g.
m(NH4)2CO3 = m(amestecuri) - m(Ca 3 (PO 4) 2) - m(CaCO 3) \u003d 50 - 14 - 20 \u003d 16 g.
Răspuns. m(NH 4) 2 CO 3 \u003d 16 g.
Sarcini calitative
1. Compusul A solid, alb, foarte solubil în apă este un acid. Când se adaugă oxidul B la o soluție apoasă A, se formează un compus alb, insolubil în apă C. Ca rezultat al calcinării substanței C la temperatură ridicată în prezența nisipului și a cărbunelui, se formează o substanță simplă care face parte din A. Identificați substanțele, scrieți ecuațiile reacției.
Răspuns. Substanțe: A - H 2 PO 4, B - CaO,
C-Ca3 (P04)2.
2. Un amestec de două solide roșii (A) și albe (B) se aprinde la frecare ușoară. Reacția produce două solide albe, dintre care unul (C) se dizolvă în apă pentru a forma o soluție acidă. Dacă la substanța C se adaugă oxid de calciu, se formează un compus alb, insolubil în apă. Identificați substanțele, scrieți ecuațiile de reacție.
Răspuns. Substanțe: A - P (cr.), B - KClO 3,
C - P 2 O 5.
3. Compusul A insolubil în apă de culoare albă, ca urmare a calcinării la temperatură ridicată cu cărbune și nisip în absența oxigenului, formează o substanță B simplă, care există în mai multe modificări alotrope. Când se arde substanța B, se formează compusul C, care se dizolvă în apă pentru a forma acidul E, care este capabil să formeze trei tipuri de săruri. Identificați substanțele, scrieți ecuațiile de reacție.
Răspuns. Substanțe: A - Ca 3 (PO 4) 2, B - P,
C-P2O5, E-H3PO4.
* Semnul +/– înseamnă că această reacție nu are loc cu toți reactivii sau în condiții specifice.
** Interesantă este reacția redox (ORD) care apare la aprinderea chibriturilor:
Va urma
Când găsiți o eroare pe pagină, selectați-o și apăsați Ctrl + Enter
Obține fosfină
Când fosforul alb este încălzit cu o soluție alcalină puternică, fosforul este disproporționat, ducând la formarea de fosfat și fosfină PH 3. Concomitent cu fosfina, se formează o cantitate mică de difosfină P 2 H 4 (un analog fosforic al hidrazinei), care se aprinde cu ușurință în aer. În același timp, se formează hidrogen. Dacă tubul de ieșire a gazului este direcționat sub apă, bulele de fosfină se ard în timp ce plutesc în sus; aceasta produce inele de fum alb.
Oferim o descriere a experienței din atelier Ripan R. Chetyanu I. Ghid de lucru practic în chimie anorganică .
Obținerea fosfură de hidrogen prin încălzirea fosforului alb cu o soluție 30-50% de potasiu caustic. Ecuația reacției:
4P + 3KOH + 3H 2 O \u003d PH 3 + 3KH 2 PO 2
Cu această metodă de producție, pe lângă hidrogen fosfură gazoasă, hidrogen fosfură lichidă, hidrogen gazos și hipofosfit acid de potasiu se formează, de asemenea, conform ecuațiilor:
6P + 4KOH + 4H 2 O \u003d P 2 H 4 + 4KH 2 PO 2
2P + 2KOH + 2H 2 O \u003d H 2 + 2KH 2 PO 2
Hidrogen fosfura lichidă, interacționând cu hidroxidul de potasiu într-un mediu apos, formează hidrogen fosfură gazoasă, hidrogen și hipofosfit acid de potasiu conform ecuațiilor:
2P 2 H 4 + KOH + H 2 O \u003d 3PH 3 + KH 2 PO 2
P 2 H 4 + 2KOH + 2H 2 O \u003d 3H 2 + 2KH 2 PO 2
Hipofosfitul acid de potasiu într-un mediu alcalin se transformă în ortofosfat de potasiu cu eliberare de hidrogen:
KH 2 PO 2 + 2KOH \u003d 2H 2 + K 3 PO 4
Conform ecuațiilor de reacție de mai sus, când fosforul alb este încălzit cu hidroxid de potasiu, se formează hidrogen fosfură gazoasă, hidrogen și ortofosfat de potasiu.
Fosfina astfel obtinuta se aprinde spontan. Acest lucru se datorează faptului că conține niște vapori de hidrogen fosfor lichid cu autoaprindere (difosfină) și hidrogen.
În loc de hidroxid de potasiu, pot fi utilizați hidrați de oxid de sodiu, calciu sau bariu. Reacțiile cu ei decurg în mod similar.
Aparatul este un balon cu fund rotund cu o capacitate de 100-250 ml, închis ermetic cu dop de cauciuc, prin care trebuie trecut etanș un tub, direcționând produsele gazoase într-un cristalizator cu apă.
Balonul se umple la 3/4 din volum cu o soluție 30-50% de potasiu caustic, în care se aruncă 2-3 bucăți de fosfor alb, de mărimea unui bob de mazăre. Balonul este fixat într-o clemă de trepied și conectat la un cristalizator umplut cu apă folosind un tub de evacuare a gazului (vezi figura).
Când balonul este încălzit, hidroxidul de potasiu reacţionează cu fosforul alb conform ecuaţiilor de mai sus.
Fosfura de hidrogen lichidă (difosfină), după ce a ajuns la suprafața lichidului din balon, se aprinde imediat și se arde sub formă de scântei; aceasta continuă până când se epuizează oxigenul rămas în balon.
Când balonul este încălzit puternic, hidrogenul fosfurat lichid este distilat și hidrogenul fosfurat gazos și hidrogenul se aprind peste apă. Hidrogenul fosforic arde cu o flacără galbenă, formând anhidridă de fosfor sub formă de inele de fum alb.
La sfârșitul experimentului, reduceți flacăra de sub balon, scoateți dopul cu tubul de ieșire, opriți încălzirea și lăsați dispozitivul la curent până se răcește complet.
Fosforul neutilizat este spălat bine cu apă și depozitat pentru experimentele ulterioare.
Am decis să luăm fosfină. Soda caustică a fost turnată într-o eprubetă și apă a fost turnată până la jumătate. O parte din alcali a rămas în sediment. Eprubeta a fost fixată oblic într-un trepied, a fost pusă în ea o bucată de fosfor galben de mărimea unui bob de mazăre și închisă cu un dop cu un tub de evacuare a gazului, al cărui capăt a fost coborât într-un cristalizator cu apă. A început încălzirea.
Bulele de gaz au început să barbote în cristalizator. De-a lungul timpului, au început fulgerări galbene, însoțite de pops: bulele au izbucnit și s-au aprins în aer. După fulgerări, se formau adesea inele frumoase de fum alb, care se ridicau.
Conform observațiilor noastre, experimentul a fost cel mai bine obținut atunci când lichidul din eprubetă fierbea activ și o parte din lichid a fost aruncată în apa cristalizatorului. În unele cazuri, s-a dovedit că sclipirile au apărut mai rar și mai slabe dacă capătul tubului de aerisire a fost coborât prea adânc în apă.
În general, „focuri de artificii cu inele de fum” au durat până la câteva minute. Este sigur să spunem că aceasta este una dintre cele mai frumoase experiențe.
________________________________________