ΧΑΛΚΟΓΟΝΑ
ΥΠΟΟΜΑΔΑ ΜΕΣΩ. ΧΑΛΚΟΓΟΝΑ
ΟΞΥΓΟΝΟ
Το στοιχείο οξυγόνο Ο είναι το όγδοο στοιχείο του περιοδικού πίνακα των στοιχείων και το πρώτο στοιχείο της υποομάδας VIA (Πίνακας 7α). Αυτό το στοιχείο είναι πιο άφθονο στον φλοιό της γης, αντιπροσωπεύοντας περίπου το 50% (wt.). Στον αέρα που αναπνέουμε, τα ΧΑΛΚΟΓΟΝΑ περιέχουν 20% οξυγόνο σε ελεύθερη (αδέσμευτη) κατάσταση και το 88% του οξυγόνου βρίσκεται στην υδρόσφαιρα σε δεσμευμένη κατάσταση με τη μορφή νερού H2O.
Το πιο κοινό ισότοπο είναι το 168O. Ο πυρήνας ενός τέτοιου ισοτόπου περιέχει 8 πρωτόνια και 8 νετρόνια. Το ισότοπο με 10 νετρόνια, 188O, είναι σημαντικά λιγότερο κοινό (0,2%). Ένα ακόμη λιγότερο κοινό (0,04%) ισότοπο με 9 νετρόνια, 178O. Η μέση σταθμισμένη μάζα όλων των ισοτόπων είναι 16.044. Εφόσον η ατομική μάζα του ισοτόπου άνθρακα με αριθμό μάζας 12 είναι ακριβώς 12.000 και όλες οι άλλες ατομικές μάζες βασίζονται σε αυτό το πρότυπο, τότε η ατομική μάζα οξυγόνου σύμφωνα με αυτό το πρότυπο πρέπει να είναι 15.9994.
Το οξυγόνο είναι ένα διατομικό αέριο, όπως το υδρογόνο, το άζωτο και τα αλογόνα φθόριο, χλώριο (το βρώμιο και το ιώδιο σχηματίζουν επίσης διατομικά μόρια, αλλά δεν είναι αέρια). Το μεγαλύτερο μέρος του οξυγόνου που χρησιμοποιείται στη βιομηχανία λαμβάνεται από την ατμόσφαιρα. Για να επιτευχθεί αυτό, έχουν αναπτυχθεί σχετικά φθηνές μέθοδοι για την υγροποίηση του χημικά καθαρού αέρα με χρήση κύκλων συμπίεσης και ψύξης. Ο υγροποιημένος αέρας θερμαίνεται αργά, απελευθερώνοντας περισσότερες πτητικές και εύκολα εξατμιζόμενες ενώσεις και συσσωρεύεται υγρό οξυγόνο. Αυτή η μέθοδος ονομάζεται κλασματική απόσταξη ή διόρθωση υγρού αέρα. Σε αυτή την περίπτωση, η μόλυνση του οξυγόνου με ακαθαρσίες αζώτου είναι αναπόφευκτη και για να ληφθεί οξυγόνο υψηλής καθαρότητας, η διαδικασία διόρθωσης επαναλαμβάνεται μέχρι να απομακρυνθεί πλήρως το άζωτο.
Δείτε επίσης ΑΕΡΑ.
Σε θερμοκρασία 182,96 ° C και πίεση 1 atm, το οξυγόνο μετατρέπεται από ένα άχρωμο αέριο σε ένα απαλό μπλε υγρό. Η παρουσία χρώματος δείχνει ότι η ουσία περιέχει μόρια με ασύζευκτα ηλεκτρόνια. Στους 218,7° C, το οξυγόνο στερεοποιείται. Το αέριο O2 είναι 1,105 φορές βαρύτερο από τον αέρα και στους 0° C και 1 atm 1 λίτρο οξυγόνου έχει μάζα 1,429 g. Το αέριο είναι ελαφρώς διαλυτό στο νερό (CHALCOGENS 0,30 cm 3 / l στους 20 ° C), αλλά αυτό είναι σημαντικό για την ύπαρξη ζωής στο νερό. Μεγάλες μάζες οξυγόνου χρησιμοποιούνται στη βιομηχανία χάλυβα για την ταχεία απομάκρυνση των ανεπιθύμητων ακαθαρσιών, κυρίως άνθρακα, θείου και φωσφόρου, με τη μορφή οξειδίων κατά τη διαδικασία εμφύσησης ή απευθείας με εμφύσηση οξυγόνου μέσω του τήγματος. Μία από τις σημαντικές χρήσεις του υγρού οξυγόνου είναι ως οξειδωτικό καυσίμου πυραύλων. Το οξυγόνο που αποθηκεύεται σε φιάλες χρησιμοποιείται στην ιατρική για τον εμπλουτισμό του αέρα με οξυγόνο, καθώς και στην τεχνολογία για τη συγκόλληση και την κοπή μετάλλων.
Σχηματισμός οξειδίων.Τα μέταλλα και τα αμέταλλα αντιδρούν με το οξυγόνο για να σχηματίσουν οξείδια. Οι αντιδράσεις μπορεί να συμβούν με την απελευθέρωση μεγάλης ποσότητας ενέργειας και να συνοδεύονται από ισχυρή λάμψη, λάμψη και καύση. Το φως του φλας παράγεται από την οξείδωση φύλλου αλουμινίου ή μαγνησίου ή σύρματος. Εάν σχηματιστούν αέρια κατά την οξείδωση, διαστέλλονται ως αποτέλεσμα της θερμότητας της αντίδρασης και μπορεί να προκαλέσουν έκρηξη. Δεν αντιδρούν όλα τα στοιχεία με το οξυγόνο για να απελευθερώσουν θερμότητα. Τα οξείδια του αζώτου, για παράδειγμα, σχηματίζονται με την απορρόφηση της θερμότητας. Το οξυγόνο αντιδρά με στοιχεία, σχηματίζοντας οξείδια των αντίστοιχων στοιχείων α) σε κανονικές ή β) σε υψηλές καταστάσεις οξείδωσης. Ξύλο, χαρτί και πολλές φυσικές ουσίες ή οργανικά προϊόντα που περιέχουν άνθρακα και υδρογόνο καίγονται στον τύπο (α), παράγοντας, για παράδειγμα, CO ή στον τύπο (β), παράγοντας CO2.
Οζο.Εκτός από το ατομικό (μονατομικό) οξυγόνο O και το μοριακό (διατομικό) οξυγόνο O2, υπάρχει το όζον, μια ουσία της οποίας τα μόρια αποτελούνται από τρία άτομα οξυγόνου O3. Αυτές οι μορφές είναι αλλοτροπικές τροποποιήσεις. Περνώντας μια αθόρυβη ηλεκτρική εκκένωση μέσω ξηρού οξυγόνου, λαμβάνεται το όζον:
3O2 2O3 Το όζον έχει έντονη, ερεθιστική οσμή και βρίσκεται συχνά κοντά σε ηλεκτρικούς κινητήρες ή γεννήτριες. Το όζον είναι πιο χημικά ενεργό από το οξυγόνο στις ίδιες θερμοκρασίες. Συνήθως αντιδρά σχηματίζοντας οξείδια και απελευθερώνει ελεύθερο οξυγόνο, για παράδειγμα: Hg + O3 -> HgO + O2 Το όζον είναι αποτελεσματικό για τον καθαρισμό (απολύμανση) του νερού, για τη λεύκανση υφασμάτων, το άμυλο, τα έλαια καθαρισμού, την ξήρανση και τη γήρανση του ξύλου και του τσαγιού, και στην παραγωγή βανιλίνης και καμφοράς. Βλέπε ΟΞΥΓΟΝΟ.
ΘΕΙΟ, ΣΕΛΗΝΙΟ, ΤΕΛΛΟΥΡΟ, ΠΟΛΩΝΙΟ
Κατά τη μετάβαση από το οξυγόνο στο πολώνιο στην υποομάδα VIA, η αλλαγή των ιδιοτήτων από μη μεταλλικό σε μεταλλικό είναι λιγότερο έντονη από ό,τι για στοιχεία της υποομάδας VA. Η ηλεκτρονική δομή των χαλκογόνων ns2np4 υποδηλώνει αποδοχή ηλεκτρονίων αντί για δωρεά ηλεκτρονίων. Η μερική απόσυρση ηλεκτρονίων από το ενεργό μέταλλο στο χαλκογόνο είναι δυνατή με το σχηματισμό μιας ένωσης με μερική ιοντική φύση του δεσμού, αλλά όχι στον ίδιο βαθμό ιονισμού με παρόμοια ένωση με οξυγόνο. Τα βαρέα μέταλλα σχηματίζουν χαλκογονίδια με ομοιοπολικούς δεσμούς· οι ενώσεις είναι έγχρωμες και εντελώς αδιάλυτες.
Μοριακές μορφές.Ο σχηματισμός μιας οκτάδας ηλεκτρονίων γύρω από κάθε άτομο επιτυγχάνεται στη στοιχειακή κατάσταση από τα ηλεκτρόνια γειτονικών ατόμων. Ως αποτέλεσμα, για παράδειγμα, στην περίπτωση του θείου, λαμβάνεται ένα κυκλικό μόριο S8, κατασκευασμένο σαν στέμμα. Δεν υπάρχει ισχυρός δεσμός μεταξύ των μορίων, έτσι το θείο λιώνει, βράζει και εξατμίζεται σε χαμηλές θερμοκρασίες. Το σελήνιο, το οποίο σχηματίζει το μόριο Se8, έχει παρόμοια δομή και σύνολο ιδιοτήτων. Το τελλούριο μπορεί να σχηματίζει αλυσίδες Te8, αλλά αυτή η δομή δεν έχει καθοριστεί με σαφήνεια. Η μοριακή δομή του πολωνίου είναι επίσης ασαφής. Η πολυπλοκότητα της δομής των μορίων καθορίζει τις διάφορες μορφές ύπαρξής τους σε στερεές, υγρές και αέριες καταστάσεις (αλλοτροπία)· αυτή η ιδιότητα είναι προφανώς ένα διακριτικό χαρακτηριστικό των χαλκογόνων μεταξύ άλλων ομάδων στοιχείων. Η πιο σταθερή μορφή θείου είναι η α-μορφή ή ορθορομβικό θείο. Το δεύτερο είναι μια μετασταθερή μορφή του b, ή μονοκλινικού θείου, που μπορεί να μετατραπεί σε α-θείο κατά την αποθήκευση. Άλλες τροποποιήσεις του θείου φαίνονται στο διάγραμμα:
Το A-Sulfur και το b-Sulfur είναι διαλυτά στο CS2. Άλλες μορφές θείου είναι επίσης γνωστές. Η μορφή m είναι ένα παχύρρευστο υγρό, πιθανότατα σχηματισμένο από τη δομή της «στεφάνης», γεγονός που εξηγεί την κατάσταση που μοιάζει με καουτσούκ. Όταν ο ατμός του θείου ψύχεται ή συμπυκνώνεται ξαφνικά, σχηματίζεται θείο σε σκόνη, το οποίο ονομάζεται «χρώμα θείου». Οι ατμοί, καθώς και η μωβ σκόνη που λαμβάνεται με την απότομη ψύξη των ατμών, σύμφωνα με τα αποτελέσματα μελετών σε μαγνητικό πεδίο, περιέχουν ασύζευκτα ηλεκτρόνια. Για τα Se και Te, η αλλοτροπία είναι λιγότερο χαρακτηριστική, αλλά έχει μια γενική ομοιότητα με το θείο, και οι τροποποιήσεις του σεληνίου είναι παρόμοιες με τις τροποποιήσεις του θείου.
Αντιδραστικότητα.Όλα τα στοιχεία της υποομάδας VIA αντιδρούν με δότες ενός ηλεκτρονίου (αλκαλιμέταλλα, υδρογόνο, ρίζα μεθυλίου HCH3), σχηματίζοντας ενώσεις της σύνθεσης RMR, δηλ. που εμφανίζει αριθμό συντονισμού 2, όπως HSH, CH3SCH3, NaSNa και ClSCl. Έξι ηλεκτρόνια σθένους συντονίζονται γύρω από το άτομο του χαλκογόνου, δύο στο φλοιό σθένους και τέσσερα στο φλοιό σθένους p. Αυτά τα ηλεκτρόνια μπορούν να σχηματίσουν έναν δεσμό με έναν ισχυρότερο δέκτη ηλεκτρονίων (όπως το οξυγόνο), ο οποίος τα απομακρύνει για να σχηματίσει μόρια και ιόντα. Έτσι, αυτά τα χαλκογόνα εμφανίζουν καταστάσεις οξείδωσης II, IV, VI, σχηματίζοντας κυρίως ομοιοπολικούς δεσμούς. Στην οικογένεια των χαλκογόνων, η εκδήλωση της οξειδωτικής κατάστασης VI εξασθενεί με την αύξηση του ατομικού αριθμού, αφού το ζεύγος ηλεκτρονίων ns2 συμμετέχει όλο και λιγότερο στον σχηματισμό δεσμών σε βαρύτερα στοιχεία (το φαινόμενο αδρανούς ζεύγους). Οι ενώσεις με αυτές τις καταστάσεις οξείδωσης περιλαμβάνουν SO και H2SO2 για το θείο (II). SO2 και H2SO3 για θείο(IV); SO3 και H2SO4 για θείο (IV). Οι ενώσεις άλλων χαλκογόνων έχουν παρόμοιες συνθέσεις, αν και υπάρχουν κάποιες διαφορές. Υπάρχουν σχετικά λίγες περίεργες καταστάσεις οξείδωσης. Οι μέθοδοι εξαγωγής ελεύθερων στοιχείων από φυσικές πρώτες ύλες είναι διαφορετικές για διαφορετικά χαλκογόνα. Μεγάλα κοιτάσματα ελεύθερου θείου είναι γνωστά στα πετρώματα, σε αντίθεση με μικρές ποσότητες άλλων χαλκογόνων σε ελεύθερη κατάσταση. Το ιζηματογενές θείο μπορεί να εξαχθεί γεωτεχνολογικά (η διαδικασία flash): υπερθερμασμένο νερό ή ατμός αντλείται μέσω ενός εσωτερικού σωλήνα για να λιώσει το θείο και στη συνέχεια το λιωμένο θείο πιέζεται στην επιφάνεια με πεπιεσμένο αέρα μέσω ενός εξωτερικού ομόκεντρου σωλήνα. Με αυτόν τον τρόπο, καθαρό, φθηνό θείο λαμβάνεται από κοιτάσματα στη Λουιζιάνα και κάτω από τον Κόλπο του Μεξικού στα ανοικτά των ακτών του Τέξας. Το σελήνιο και το τελλούριο εξάγονται από τις εκπομπές αερίων από τη μεταλλουργία του χαλκού, του ψευδαργύρου και του μολύβδου, καθώς και από τη λάσπη από την ηλεκτρομεταλλουργία του αργύρου και του μολύβδου. Ορισμένα εργοστάσια στα οποία συγκεντρώνεται το σελήνιο γίνονται πηγές δηλητηρίασης του ζωικού κόσμου. Το ελεύθερο θείο χρησιμοποιείται ευρέως στη γεωργία ως μυκητοκτόνο σε σκόνη. Μόνο στις ΗΠΑ, περίπου 5,1 εκατομμύρια τόνοι θείου χρησιμοποιούνται ετησίως για διάφορες διεργασίες και χημικές τεχνολογίες. Στην παραγωγή θειικού οξέος καταναλώνεται πολύ θείο.
Οι επιμέρους κατηγορίες ενώσεων χαλκογόνων, ιδιαίτερα τα αλογονίδια, ποικίλλουν πολύ ως προς τις ιδιότητες.
Ενώσεις υδρογόνου.Το υδρογόνο αντιδρά αργά με τα χαλκογόνα για να σχηματίσει υδρίδια H2M. Υπάρχει μεγάλη διαφορά μεταξύ του νερού (υδρίδιο οξυγόνου) και των υδριδίων άλλων χαλκογόνων, τα οποία είναι δύσοσμα και δηλητηριώδη, και τα υδατικά τους διαλύματα είναι αδύναμα οξέα (το ισχυρότερο είναι το H2Te). Τα μέταλλα αντιδρούν απευθείας με τα χαλκογόνα για να σχηματίσουν χαλκογονίδια (π.χ. θειούχο νάτριο Na2S, θειούχο κάλιο K2S). Το θείο σε υδατικά διαλύματα αυτών των σουλφιδίων σχηματίζει πολυσουλφίδια (για παράδειγμα, Na2Sx). Τα υδρίδια του χαλκογόνου μπορούν να εκτοπιστούν από οξινισμένα διαλύματα θειούχων μετάλλων. Έτσι, οι σουλφάνες H2Sx απελευθερώνονται από οξινισμένα διαλύματα Na2Sx (όπου το x μπορεί να είναι μεγαλύτερο από 50, ωστόσο, έχουν μελετηθεί μόνο οι σουλφάνες με x Ј 6).
Χαλίδες.Τα χαλκογόνα αντιδρούν απευθείας με τα αλογόνα για να σχηματίσουν αλογονίδια διαφόρων συνθέσεων. Το εύρος των αλογόνων που αντιδρούν και η σταθερότητα των ενώσεων που προκύπτουν εξαρτώνται από την αναλογία των ακτίνων του χαλκογόνου και του αλογόνου. Η πιθανότητα σχηματισμού αλογονιδίου με υψηλή κατάσταση οξείδωσης του χαλκογόνου μειώνεται με την αύξηση της ατομικής μάζας του αλογόνου, καθώς το ιόν αλογονιδίου θα οξειδωθεί σε αλογόνο και το χαλκογόνο θα αναχθεί σε ελεύθερο χαλκογόνο ή σε αλογονίδιο χαλκογόνου σε χαμηλή κατάσταση οξείδωσης, για παράδειγμα: TeI6 -> TeI4 + I2 Κατάσταση οξείδωσης Ι για το θείο, μπορεί να πραγματοποιηθεί στην ένωση (SCl)2 ή S2Cl2 (αυτή η σύνθεση δεν έχει τεκμηριωθεί αξιόπιστα). Το πιο ασυνήθιστο από τα αλογονίδια του θείου είναι το SF6, το οποίο είναι εξαιρετικά αδρανές. Το θείο σε αυτή την ένωση είναι τόσο ισχυρά προστατευμένο από άτομα φθορίου που ακόμη και οι πιο επιθετικές ουσίες δεν έχουν ουσιαστικά καμία επίδραση στο SF6. Από το τραπέζι 7β προκύπτει ότι το θείο και το σελήνιο δεν σχηματίζουν ιωδίδια.
Είναι γνωστά σύμπλοκα αλογονίδια χαλκογονίου, τα οποία σχηματίζονται από την αλληλεπίδραση ενός αλογονιδίου χαλκογονίου με ιόντα αλογονιδίου, για παράδειγμα,
TeCl4 + 2Cl= TeCl62.
Οξείδια και οξοξέα.Τα οξείδια του χαλκογόνου σχηματίζονται από άμεση αλληλεπίδραση με το οξυγόνο. Το θείο καίγεται στον αέρα ή το οξυγόνο για να σχηματίσει ακαθαρσίες SO2 και SO3. Άλλες μέθοδοι χρησιμοποιούνται για τη λήψη SO3. Όταν το SO2 αντιδρά με το θείο, μπορεί να σχηματιστεί SO2. Το σελήνιο και το τελλούριο σχηματίζουν παρόμοια οξείδια, αλλά έχουν σημαντικά μικρότερη σημασία στην πράξη. Οι ηλεκτρικές ιδιότητες των οξειδίων του σεληνίου και, ιδιαίτερα, του καθαρού σεληνίου καθορίζουν την ανάπτυξη της πρακτικής εφαρμογής τους στην ηλεκτρονική και ηλεκτρική βιομηχανία. Τα κράματα σιδήρου και σεληνίου είναι ημιαγωγοί και χρησιμοποιούνται για την κατασκευή ανορθωτών. Δεδομένου ότι η αγωγιμότητα του σεληνίου εξαρτάται από το φωτισμό και τη θερμοκρασία, αυτή η ιδιότητα χρησιμοποιείται στην κατασκευή φωτοκυττάρων και αισθητήρων θερμοκρασίας. Τα τριοξείδια είναι γνωστά για όλα τα στοιχεία αυτής της υποομάδας, εκτός από το πολώνιο. Η καταλυτική οξείδωση του SO2 σε SO3 αποτελεί τη βάση της βιομηχανικής παραγωγής θειικού οξέος. Το στερεό SO3 έχει αλλοτροπικές τροποποιήσεις: κρύσταλλοι που μοιάζουν με φτερά, δομή παρόμοια με τον αμίαντο, δομή παρόμοια με πάγο και πολυμερικό κυκλικό (SO3)3. Το σελήνιο και το τελλούριο διαλύονται σε υγρό SO3, σχηματίζοντας ενώσεις διαχαλκογόνων όπως SeSO3 και TeSO3. Η παραγωγή SeO3 και TeO3 συνδέεται με ορισμένες δυσκολίες. Το SeO3 λαμβάνεται από ένα μίγμα αερίων Se και O2 σε ένα σωλήνα εκκένωσης και το TeO3 σχηματίζεται από έντονη αφυδάτωση του H6TeO6. Τα αναφερόμενα οξείδια υδρολύονται ή αντιδρούν έντονα με το νερό για να σχηματίσουν οξέα. Το θειικό οξύ έχει τη μεγαλύτερη πρακτική σημασία. Για την απόκτησή του, χρησιμοποιούνται δύο διαδικασίες: η συνεχώς εξελισσόμενη μέθοδος επαφής και η απαρχαιωμένη μέθοδος νιτρωδών πύργων (βλ. επίσης ΘΕΙΟ).
Το θειικό οξύ είναι ένα ισχυρό οξύ. αλληλεπιδρά ενεργά με το νερό, απελευθερώνοντας θερμότητα σύμφωνα με την αντίδραση H2SO4 + H2O H3O+ + HSO4 Επομένως, πρέπει να λαμβάνεται μέριμνα κατά την αραίωση πυκνού θειικού οξέος, καθώς η υπερθέρμανση μπορεί να προκαλέσει την απελευθέρωση ατμών από το δοχείο με οξύ (συχνά τα εγκαύματα από θειικό οξύ σχετίζεται με την προσθήκη μικρής ποσότητας νερού). Λόγω της υψηλής συγγένειάς του με το νερό, το H2SO4 (συγκ.) αλληλεπιδρά εντατικά με τα βαμβακερά ρούχα, τη ζάχαρη και τον ζωντανό ανθρώπινο ιστό, απομακρύνοντας το νερό. Τεράστιες ποσότητες οξέος χρησιμοποιούνται για την επιφανειακή επεξεργασία μετάλλων, στη γεωργία για την παραγωγή υπερφωσφορικών (βλέπε επίσης ΦΩΣΦΟΡΟΥ), στη διύλιση του αργού πετρελαίου μέχρι το στάδιο της ανόρθωσης, στην τεχνολογία πολυμερών, στις βαφές, στη φαρμακευτική βιομηχανία και σε πολλές άλλες βιομηχανίες. Το θειικό οξύ είναι η πιο σημαντική ανόργανη ένωση από βιομηχανική άποψη. Τα οξοξέα των χαλκογόνων δίνονται στον πίνακα. 7ος αιώνας Πρέπει να σημειωθεί ότι ορισμένα οξέα υπάρχουν μόνο σε διάλυμα, άλλα μόνο με τη μορφή αλάτων.
Μεταξύ άλλων θειούχων οξοξέων, σημαντική θέση στη βιομηχανία κατέχει το θειικό οξύ H2SO3, ένα ασθενές οξύ που σχηματίζεται όταν το SO2 διαλύεται στο νερό και υπάρχει μόνο σε υδατικά διαλύματα. Τα άλατά του είναι αρκετά σταθερά. Το οξύ και τα άλατά του είναι αναγωγικοί παράγοντες και χρησιμοποιούνται ως «αντιχλωριωτικά» για την απομάκρυνση της περίσσειας χλωρίου από το λευκαντικό. Το θειοθειικό οξύ και τα άλατά του χρησιμοποιούνται στη φωτογραφία για την απομάκρυνση της περίσσειας AgBr που δεν έχει αντιδράσει από φωτογραφικό φιλμ: AgBr + S2O32 []+ Br
Το όνομα "υποθειώδες νάτριο" για το άλας νατρίου του θειοθειικού οξέος είναι ατυχές· η σωστή ονομασία "θειοθειικό" αντικατοπτρίζει τη δομική σχέση αυτού του οξέος με το θειικό οξύ, στο οποίο ένα άτομο μη ενυδατωμένου οξυγόνου αντικαθίσταται από ένα άτομο θείου (" θείο"). Τα πολυθειονικά οξέα είναι μια ενδιαφέρουσα κατηγορία ενώσεων στην οποία σχηματίζεται μια αλυσίδα ατόμων θείου, που βρίσκεται μεταξύ δύο ομάδων SO3. Υπάρχουν πολλά δεδομένα για τα παράγωγα H2S2O6, αλλά τα πολυθειονικά οξέα μπορούν επίσης να περιέχουν μεγάλο αριθμό ατόμων θείου. Τα υπεροξοξέα είναι σημαντικά όχι μόνο ως οξειδωτικά μέσα, αλλά και ως ενδιάμεσα για την παραγωγή υπεροξειδίου του υδρογόνου. Το υπεροξυδισουλφουρικό οξύ λαμβάνεται με ηλεκτρολυτική οξείδωση του ιόντος HSO4 στο κρύο. Το υπεροξοθειικό οξύ σχηματίζεται από την υδρόλυση του υπεροξοδιθειικού οξέος: 2HSO4 -> H2S2O8 + 2e
H2S2O8 + H2O -> H2SO5 + H2SO4 Το εύρος των οξέων του σεληνίου και του τελλουρίου είναι σημαντικά μικρότερο. Το σεληνώδες οξύ H2SeO3 λαμβάνεται με εξάτμιση νερού από διάλυμα SeO2. Είναι ένας οξειδωτικός παράγοντας, σε αντίθεση με το θειικό οξύ H2SO3 (αναγωγικός παράγοντας) και οξειδώνει εύκολα τα αλογονίδια σε αλογόνα. Το ζεύγος ηλεκτρονίων 4s2 του σεληνίου εμπλέκεται ανενεργά στο σχηματισμό δεσμών (το φαινόμενο αδρανούς ζεύγους, βλέπε παραπάνω στην ενότητα για την αντιδραστικότητα του θείου), και επομένως το σελήνιο περνά εύκολα στη στοιχειακή κατάσταση. Για τον ίδιο λόγο, το σεληνικό οξύ αποσυντίθεται εύκολα για να σχηματίσει H2SeO3 και Se. Το άτομο Te έχει μεγαλύτερη ακτίνα και επομένως είναι αναποτελεσματικό στο σχηματισμό διπλών δεσμών. Επομένως, το τελλουρικό οξύ δεν υπάρχει στη συνηθισμένη του μορφή.

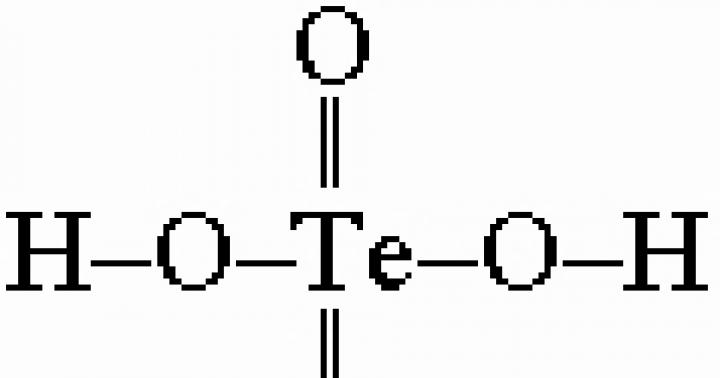
και 6 υδροξοομάδες συντονίζονται από το τελλούριο για να σχηματίσουν H6TeO6 ή Te(OH)6.
Οξοχαλίδες.Τα οξοξέα και τα οξείδια του χαλκογόνου αντιδρούν με αλογόνα και PX5, σχηματίζοντας οξοαλογονίδια της σύνθεσης ΜΟΧ2 και ΜΟ2Χ2. Για παράδειγμα, το SO2 αντιδρά με το PCl5 για να σχηματίσει SOCl2 (θειονυλοχλωρίδιο):
PCl5 + SO2 -> POCl3 + SOCl2
Το αντίστοιχο φθόριο SOF2 σχηματίζεται από την αλληλεπίδραση των SOCl2 και SbF3 και το θειονυλοβρωμίδιο SOBr2 σχηματίζεται από τα SOCl2 και HBr. Το σουλφουρυλοχλωρίδιο SO2Cl2 λαμβάνεται με χλωρίωση του SO2 με χλώριο (παρουσία καμφοράς)· το σουλφουρυλοφθορίδιο SO2F2 λαμβάνεται παρομοίως. Το χλωροφθορίδιο SO2ClF σχηματίζεται από SO2Cl2, SbF3 και SbCl3. Το χλωροσουλφονικό οξύ HOSO2Cl λαμβάνεται με τη διέλευση του χλωρίου μέσω του ατμίζοντος θειικού οξέος. Το φθοροσουλφονικό οξύ σχηματίζεται με παρόμοιο τρόπο. Τα οξοαλογονίδια σεληνίου SeOCl2, SeOF2, SeOBr2 είναι επίσης γνωστά.
Ενώσεις που περιέχουν άζωτο και θείο.Το θείο σχηματίζει διάφορες ενώσεις με το άζωτο, πολλές από τις οποίες έχουν μελετηθεί ελάχιστα. Όταν το S2Cl2 υποβάλλεται σε επεξεργασία με αμμωνία, σχηματίζονται N4S4 (τετρανιτρίδιο τετραθείου), S7HN (επτασιμίδιο θείου) και άλλες ενώσεις. Τα μόρια S7HN είναι κατασκευασμένα σαν ένα κυκλικό μόριο S8, στο οποίο ένα άτομο θείου αντικαθίσταται από άζωτο. Το N4S4 σχηματίζεται επίσης από θείο και αμμωνία. Μετατρέπεται σε τετραθείο τετραϊμίδιο S4N4H4 με τη δράση του κασσίτερου και του υδροχλωρικού οξέος. Ένα άλλο παράγωγο αζώτου, το σουλφαμικό οξύ NH2SO3H, είναι βιομηχανικής σημασίας· είναι μια λευκή, μη υγροσκοπική κρυσταλλική ουσία. Λαμβάνεται με αντίδραση ουρίας ή αμμωνίας με ατμίζον θειικό οξύ. Αυτό το οξύ είναι κοντά σε ισχύ με το θειικό οξύ. Το άλας αμμωνίου του NH4SO3NH2 χρησιμοποιείται ως αναστολέας της φωτιάς και τα άλατα αλκαλιμετάλλων ως ζιζανιοκτόνα.
Πολώνιο.Παρά την περιορισμένη ποσότητα πολωνίου, η χημεία αυτού του τελευταίου στοιχείου της υποομάδας VIA είναι σχετικά καλά κατανοητή χάρη στη ραδιενεργή ιδιότητά του (συνήθως στις χημικές αντιδράσεις αναμιγνύεται με τελλούριο ως φορέας ή συνοδευτικό αντιδραστήριο). Ο χρόνος ημιζωής του πιο σταθερού ισοτόπου 210Po είναι μόνο 138,7 ημέρες, επομένως οι δυσκολίες μελέτης του είναι κατανοητές. Για να ληφθεί 1 g Po, είναι απαραίτητη η επεξεργασία περισσότερων από 11,3 τόνων πίσσας ουρανίου. Το 210Po μπορεί να παραχθεί με βομβαρδισμό νετρονίων του 209Bi, το οποίο πρώτα μετασχηματίζεται σε 210Bi και στη συνέχεια εκτοξεύει ένα σωματίδιο b για να σχηματίσει 210Po. Προφανώς, το πολώνιο εμφανίζει τις ίδιες καταστάσεις οξείδωσης με άλλα χαλκογόνα. Έχουν συντεθεί υδρίδιο του πολωνίου H2Po και οξείδιο PoO2· άλατα με καταστάσεις οξείδωσης II και IV είναι γνωστά. Προφανώς το PoO3 δεν υπάρχει.
Εγκυκλοπαίδεια Collier. - Ανοικτή Κοινωνία. 2000 .
Δείτε τι είναι τα "CHALCOGENS" σε άλλα λεξικά:
ΧΑΛΚΟΓΟΝΑ, χημικά στοιχεία της ομάδας VI του περιοδικού πίνακα: οξυγόνο, θείο, σελήνιο, τελλούριο. Ενώσεις χαλκογόνων με περισσότερα ηλεκτροθετικά χημικά στοιχεία χαλκογονίδια (οξείδια, σουλφίδια, σεληνίδια, τελουρίδια) ... Σύγχρονη εγκυκλοπαίδεια
Χημικά στοιχεία της ομάδας VI του περιοδικού πίνακα οξυγόνο, θείο, σελήνιο, τελλούριο... Μεγάλο Εγκυκλοπαιδικό Λεξικό
Ομάδα → 16 ↓ Περίοδος 2 8 Οξυγόνο ... Wikipedia
Χημικά στοιχεία της ομάδας VI του περιοδικού πίνακα: οξυγόνο, θείο, σελήνιο, τελλούριο. * * * ΧΑΛΚΟΓΟΝΑ ΧΑΛΚΟΓΟΝΑ, χημικά στοιχεία της ομάδας VI του Περιοδικού Πίνακα οξυγόνο, θείο, σελήνιο, τελλούριο... εγκυκλοπαιδικό λεξικό
χαλκογόνα- chalkogenai statusas T sritis chemija apibrėžtis S, Se, Te, (Po). ατιτικμενύς: αγγλ. chalcogens rus. χαλκογόνα... Chemijos terminų aiškinamasis žodynas
Chem. στοιχεία VIa gr. περιοδικός συστήματα: οξυγόνο Ο, θείο S, σελήνιο Se, τελλούριο Te, πολώνιο Ρο. Εξωτ. Το ηλεκτρονιακό κέλυφος των ατόμων Χ έχει τη διαμόρφωση s2p4. Με αύξηση σε. n. Η ομοιοπολική και η ιοντική ακτίνα Χ αυξάνονται, η ενέργεια μειώνεται... ... Χημική εγκυκλοπαίδεια
Στην ομάδα VIA του περιοδικού συστήματος στοιχείων D.I. Τα στοιχεία του Mendeleev περιλαμβάνουν οξυγόνο, θείο, σελήνιο, τελλούριο και πολώνιο. Τα πρώτα τέσσερα από αυτά είναι μη μεταλλικής φύσης. Γενική ονομασία των στοιχείων αυτής της ομάδας χαλκογόνα,που μεταφράζεται από τα ελληνικά. σημαίνει «σχηματισμός μεταλλευμάτων», υποδεικνύοντας την εμφάνισή τους στη φύση.
Ηλεκτρονικός τύπος του κελύφους σθένους ατόμων στοιχείων της ομάδας VI.
Τα άτομα αυτών των στοιχείων έχουν 6 ηλεκτρόνια σθένους στα τροχιακά s και p του εξωτερικού ενεργειακού επιπέδου. Από αυτά, δύο p-τροχιακά είναι μισογεμάτα.
Το άτομο οξυγόνου διαφέρει από τα άτομα άλλων χαλκογόνων απουσία ενός χαμηλού d-υποεπιπέδου. Επομένως, το οξυγόνο, κατά κανόνα, είναι σε θέση να σχηματίσει μόνο δύο δεσμούς με άτομα άλλων στοιχείων. Ωστόσο, σε ορισμένες περιπτώσεις, η παρουσία μεμονωμένων ζευγών ηλεκτρονίων στο εξωτερικό ενεργειακό επίπεδο επιτρέπει στο άτομο οξυγόνου να σχηματίσει πρόσθετους δεσμούς μέσω του μηχανισμού δότη-δέκτη.
Για άτομα άλλων χαλκογόνων, όταν η ενέργεια παρέχεται από έξω, ο αριθμός των μη ζευγαρωμένων ηλεκτρονίων μπορεί να αυξηθεί ως αποτέλεσμα της μετάβασης των ηλεκτρονίων s και p στο d-υποεπίπεδο. Επομένως, τα άτομα θείου και άλλων χαλκογόνων είναι ικανά να σχηματίζουν όχι μόνο 2, αλλά και 4 και 6 δεσμούς με άτομα άλλων στοιχείων. Για παράδειγμα, σε μια διεγερμένη κατάσταση ενός ατόμου θείου, τα ηλεκτρόνια του εξωτερικού ενεργειακού επιπέδου μπορούν να αποκτήσουν την ηλεκτρονική διαμόρφωση 3s 2 3p 3 3d 1 και 3s 1 3p 3 3d 2:
Ανάλογα με την κατάσταση του κελύφους ηλεκτρονίων, εμφανίζονται διαφορετικές καταστάσεις οξείδωσης (CO). Σε ενώσεις με μέταλλα και υδρογόνο, στοιχεία αυτής της ομάδας εμφανίζουν CO = -2. Σε ενώσεις με οξυγόνο και αμέταλλα, το θείο, το σελήνιο και το τελλούριο μπορεί να έχουν CO = +4 και CO = +6. Σε ορισμένες ενώσεις εμφανίζουν CO = +2.
Το οξυγόνο είναι δεύτερο μόνο μετά το φθόριο σε ηλεκτραρνητικότητα. Στο φθοροξείδιο F2O, η κατάσταση οξείδωσης του οξυγόνου είναι θετική και ίση με +2. Με άλλα στοιχεία, το οξυγόνο εμφανίζει συνήθως κατάσταση οξείδωσης -2 σε ενώσεις, με εξαίρεση το υπεροξείδιο του υδρογόνου H 2 O 2 και τα παράγωγά του, στα οποία το οξυγόνο έχει κατάσταση οξείδωσης -1. Στους ζωντανούς οργανισμούς, το οξυγόνο, το θείο και το σελήνιο αποτελούν μέρος των βιομορίων σε κατάσταση οξείδωσης -2.
Στη σειρά O - S - Se-Te - Po αυξάνονται οι ακτίνες των ατόμων και των ιόντων. Αντίστοιχα, η ενέργεια ιοντισμού και η σχετική ηλεκτραρνητικότητα μειώνονται φυσικά προς την ίδια κατεύθυνση.
Με την αύξηση του τακτικού αριθμού των στοιχείων της ομάδας VI, η οξειδωτική δραστηριότητα των ουδέτερων ατόμων μειώνεται και η αναγωγική δραστηριότητα των αρνητικών ιόντων αυξάνεται. Όλα αυτά οδηγούν σε εξασθένηση των μη μεταλλικών ιδιοτήτων των χαλκογόνων κατά τη μετάβαση από το οξυγόνο στο τελλούριο.
Καθώς ο ατομικός αριθμός των χαλκογόνων αυξάνεται, οι χαρακτηριστικοί αριθμοί συντονισμού αυξάνονται. Αυτό οφείλεται στο γεγονός ότι κατά τη μετάβαση από τα στοιχεία p της τέταρτης περιόδου στα στοιχεία p της πέμπτης και έκτης περιόδου στο σχηματισμό των σ- και π-δεσμών d αρχίζουν να διαδραματίζουν όλο και πιο σημαντικό ρόλο - και ακόμη και f-τροχιακά. Έτσι, εάν για το θείο και το σελήνιο οι πιο χαρακτηριστικοί αριθμοί συντονισμού είναι το 3 και το 4, τότε για το τελλούριο - 6 και ακόμη και 8.
Υπό κανονικές συνθήκες, οι ενώσεις υδρογόνου H 2 E των στοιχείων της ομάδας VIA, με εξαίρεση το νερό, είναι αέρια με πολύ δυσάρεστη οσμή. Η θερμοδυναμική σταθερότητα αυτών των ενώσεων μειώνεται από το νερό στο τελλουρίδιο υδρογόνου H 2 Te. Σε υδατικά διαλύματα παρουσιάζουν ελαφρώς όξινες ιδιότητες. Στη σειρά H 2 O-H 2 S-H 2 Se-H 2 Te, η ισχύς των οξέων αυξάνεται.
Αυτό εξηγείται από την αύξηση των ακτίνων των ιόντων E 2- και την αντίστοιχη εξασθένηση των δεσμών E-H. Η αναγωγική ικανότητα του H2E αυξάνεται προς την ίδια κατεύθυνση.
Το θείο, το σελήνιο και το τελλούριο σχηματίζουν δύο σειρές οξειδίων οξέος: EO 2 και EO 3. Αντιστοιχούν σε όξινα υδροξείδια της σύνθεσης H 2 EO 3 και H 2 EO 4. Τα οξέα H 2 EO 3 στην ελεύθερη κατάσταση είναι ασταθή. Τα άλατα αυτών των οξέων και τα ίδια τα οξέα εμφανίζουν δυαδικότητα οξειδοαναγωγής, καθώς τα στοιχεία S, Se και Te σε αυτές τις ενώσεις έχουν μια ενδιάμεση κατάσταση οξείδωσης +4.
Τα οξέα της σύνθεσης H 2 EO 4 είναι πιο σταθερά και συμπεριφέρονται ως οξειδωτικά μέσα στις αντιδράσεις (η υψηλότερη κατάσταση οξείδωσης του στοιχείου είναι +6).
Χημικές ιδιότητες ενώσεων οξυγόνου.Το οξυγόνο είναι το πιο άφθονο στοιχείο στον φλοιό της γης (49,4%). Η υψηλή περιεκτικότητα και η υψηλή χημική δραστηριότητα του οξυγόνου καθορίζουν την κυρίαρχη μορφή ύπαρξης των περισσότερων στοιχείων της Γης με τη μορφή ενώσεων που περιέχουν οξυγόνο. Το οξυγόνο είναι μέρος όλων των ζωτικών οργανικών ουσιών - πρωτεΐνες, λίπη, υδατάνθρακες.
Χωρίς οξυγόνο, πολλές εξαιρετικά σημαντικές διαδικασίες ζωής είναι αδύνατες, όπως η αναπνοή, η οξείδωση των αμινοξέων, των λιπών και των υδατανθράκων. Μόνο λίγα φυτά, που ονομάζονται αναερόβια, μπορούν να επιβιώσουν χωρίς οξυγόνο.
Στα ανώτερα ζώα (Εικ. 8.7), το οξυγόνο διεισδύει στο αίμα και συνδυάζεται με την αιμοσφαιρίνη, σχηματίζοντας την εύκολα διασπώμενη ένωση οξυαιμοσφαιρίνη. Με τη ροή του αίματος, αυτή η ένωση εισέρχεται στα τριχοειδή αγγεία διαφόρων οργάνων. Εδώ, το οξυγόνο διασπάται από την αιμοσφαιρίνη και διαχέεται μέσω των τοιχωμάτων των τριχοειδών αγγείων στους ιστούς. Η σύνδεση μεταξύ αιμοσφαιρίνης και οξυγόνου είναι εύθραυστη και συμβαίνει λόγω της αλληλεπίδρασης δότη-δέκτη με το ιόν Fe 2+.
Σε κατάσταση ηρεμίας, ένα άτομο εισπνέει περίπου 0,5 m 3 αέρα την ώρα. Όμως μόνο το 1/5 του οξυγόνου που εισπνέεται με τον αέρα συγκρατείται στο σώμα. Ωστόσο, η περίσσεια οξυγόνου (4/5) είναι απαραίτητη για τη δημιουργία υψηλής συγκέντρωσης οξυγόνου στο αίμα. Αυτό, σύμφωνα με το νόμο του Fick, εξασφαλίζει επαρκή ρυθμό διάχυσης οξυγόνου μέσω των τοιχωμάτων των τριχοειδών αγγείων. Έτσι, ένα άτομο χρησιμοποιεί στην πραγματικότητα περίπου 0,1 m 3 οξυγόνου την ημέρα.
Το οξυγόνο καταναλώνεται στους ιστούς. για την οξείδωση διαφόρων ουσιών. Αυτές οι αντιδράσεις οδηγούν τελικά στον σχηματισμό διοξειδίου του άνθρακα, αποθήκευσης νερού και ενέργειας.
Το οξυγόνο καταναλώνεται όχι μόνο στη διαδικασία της αναπνοής, αλλά και στη διαδικασία αποσύνθεσης φυτικών και ζωικών υπολειμμάτων. Ως αποτέλεσμα της διαδικασίας αποσύνθεσης πολύπλοκων οργανικών ουσιών, σχηματίζονται τα προϊόντα οξείδωσής τους: CO 2, H 2 O κ.λπ. Η αναγέννηση του οξυγόνου συμβαίνει στα φυτά.
Έτσι, ως αποτέλεσμα του κύκλου του οξυγόνου στη φύση, διατηρείται σταθερή η περιεκτικότητά του στην ατμόσφαιρα. Φυσικά, ο κύκλος του οξυγόνου στη φύση σχετίζεται στενά με τον κύκλο του άνθρακα (Εικ. 8.8).
Το στοιχείο οξυγόνο υπάρχει με τη μορφή δύο απλών ουσιών (αλλοτροπικές τροποποιήσεις): διοξυγόνο(οξυγόνο) O 2 και τριοξυγόνο(όζον) O 3 . Στην ατμόσφαιρα, σχεδόν όλο το οξυγόνο περιέχεται με τη μορφή οξυγόνου O 2, ενώ η περιεκτικότητα σε όζον είναι πολύ μικρή. Το μέγιστο κλάσμα όγκου του όζοντος σε υψόμετρο 22 km είναι μόνο 10 -6%.
Το μόριο οξυγόνου O2 είναι πολύ σταθερό απουσία άλλων ουσιών. Η παρουσία δύο ασύζευκτων ηλεκτρονίων στο μόριο καθορίζει την υψηλή αντιδραστικότητα του. Το οξυγόνο είναι ένα από τα πιο ενεργά αμέταλλα. Αντιδρά άμεσα με τις περισσότερες απλές ουσίες, σχηματίζοντας οξείδια E x O y. Η κατάσταση οξείδωσης του οξυγόνου σε αυτές είναι -2. Σύμφωνα με την αλλαγή στη δομή των ηλεκτρονικών κελυφών των ατόμων, η φύση του χημικού δεσμού και, κατά συνέπεια, η δομή και οι ιδιότητες των οξειδίων στις περιόδους και τις ομάδες του συστήματος στοιχείων αλλάζουν φυσικά. Έτσι, στη σειρά οξειδίων στοιχείων της δεύτερης περιόδου Li 2 O-BeO-B 2 O 3 -CO 2 -N 2 O 5 η πολικότητα του χημικού δεσμού E-O από την ομάδα I στην V μειώνεται σταδιακά. Σύμφωνα με αυτό, οι βασικές ιδιότητες εξασθενούν και οι όξινες ιδιότητες ενισχύονται: το Li 2 O είναι ένα τυπικό βασικό οξείδιο, το BeO είναι αμφοτερικό και τα B 2 O 3, CO 2 και N 2 O 5 είναι όξινα οξείδια. Οι οξεοβασικές ιδιότητες αλλάζουν παρόμοια σε άλλες περιόδους.
Στις κύριες υποομάδες (Α-ομάδες), με την αύξηση του ατομικού αριθμού του στοιχείου, συνήθως αυξάνεται η ιοντικότητα του δεσμού Ε-Ο στα οξείδια.
Αντίστοιχα, οι βασικές ιδιότητες των οξειδίων στην ομάδα Li-Na-K-Rb-Cs και σε άλλες ομάδες Α αυξάνονται.
Οι ιδιότητες των οξειδίων, λόγω αλλαγών στη φύση του χημικού δεσμού, είναι μια περιοδική συνάρτηση του φορτίου του πυρήνα του ατόμου του στοιχείου. Αυτό αποδεικνύεται, για παράδειγμα, από αλλαγές στις θερμοκρασίες τήξης και ενθαλπίες σχηματισμού οξειδίων σε περιόδους και ομάδες ανάλογα με το φορτίο του πυρήνα.
Η πολικότητα του δεσμού E-OH στα υδροξείδια Ε(ΟΗ) n, και επομένως οι ιδιότητες των υδροξειδίων, αλλάζουν φυσικά ανάλογα με τις ομάδες και τις περιόδους του συστήματος των στοιχείων.
Για παράδειγμα, στις ομάδες ΙΑ-, ΙΙΑ- και ΙΙΑ- από πάνω προς τα κάτω, με την αύξηση των ακτίνων ιόντων, η πολικότητα του δεσμού Ε-ΟΗ αυξάνεται. Ως αποτέλεσμα, ο ιονισμός E-OH → E + + OH - συμβαίνει πιο εύκολα στο νερό. Αντίστοιχα, ενισχύονται οι βασικές ιδιότητες των υδροξειδίων. Έτσι, στην ομάδα ΙΑ, οι κύριες ιδιότητες των υδροξειδίων μετάλλων αλκαλίων ενισχύονται στη σειρά Li-Na-K-Rb-Cs.
Σε περιόδους από αριστερά προς τα δεξιά, με τη μείωση των ιοντικών ακτίνων και την αύξηση του φορτίου ιόντων, η πολικότητα του δεσμού E-OH μειώνεται. Ως αποτέλεσμα, ο ιονισμός του EON ⇄ EO - + H + γίνεται πιο εύκολα στο νερό. Κατά συνέπεια, οι όξινες ιδιότητες ενισχύονται προς αυτή την κατεύθυνση. Έτσι, στην πέμπτη περίοδο, τα υδροξείδια RbOH και Sr(OH) 2 είναι βάσεις, In(OH) 3 και Sn(OH) 4 είναι αμφοτερικές ενώσεις και H και H 6 TeO 6 είναι οξέα.
Το πιο κοινό οξείδιο στη γη είναι το οξείδιο του υδρογόνου ή το νερό. Αρκεί να πούμε ότι αποτελεί το 50-99% της μάζας κάθε ζωντανού πλάσματος. Το ανθρώπινο σώμα περιέχει 70-80% νερό. Κατά τη διάρκεια των 70 ετών ζωής, ένα άτομο πίνει περίπου 25.000 κιλά νερό.
Λόγω της δομής του, το νερό έχει μοναδικές ιδιότητες. Σε έναν ζωντανό οργανισμό, είναι διαλύτης οργανικών και ανόργανων ενώσεων και συμμετέχει στις διαδικασίες ιονισμού μορίων διαλυμένων ουσιών. Το νερό δεν είναι μόνο το μέσο στο οποίο λαμβάνουν χώρα οι βιοχημικές αντιδράσεις, αλλά συμμετέχει ενεργά και σε υδρολυτικές διεργασίες.
Η ικανότητα του οξυγόνου να σχηματίζεται είναι ζωτικής σημασίας οξυγονυλσύμπλοκα με διάφορες ουσίες. Προηγουμένως, εξετάστηκαν παραδείγματα συμπλεγμάτων οξυγονυλίου O2 με μεταλλικά ιόντα - φορείς οξυγόνου σε ζωντανούς οργανισμούς - οξυαιμοσφαιρίνη και οξυαιμοκυανίνη:
НbFe 2 + + О 2 → НbFe 2+ ∙О 2
НсСu 2+ + О 2 → НсСu 2+ ∙О 2
όπου Hb είναι αιμοσφαιρίνη, Hc είναι αιμοκυανίνη.
Έχοντας δύο μεμονωμένα ζεύγη ηλεκτρονίων, το οξυγόνο δρα ως δότης σε αυτές τις ενώσεις συντονισμού με μεταλλικά ιόντα. Σε άλλες ενώσεις, το οξυγόνο σχηματίζει διάφορους δεσμούς υδρογόνου.
Επί του παρόντος, δίνεται μεγάλη προσοχή στην παρασκευή οξυγονυλικών συμπλοκών μετάλλων μετάπτωσης, τα οποία θα μπορούσαν να επιτελούν λειτουργίες παρόμοιες με αυτές των αντίστοιχων βιοοργανικών συμπλόκων ενώσεων. Η σύνθεση της σφαίρας εσωτερικού συντονισμού αυτών των συμπλεγμάτων είναι παρόμοια με τα φυσικά ενεργά κέντρα. Συγκεκριμένα, τα σύμπλοκα κοβαλτίου με αμινοξέα και ορισμένους άλλους συνδέτες είναι πολλά υποσχόμενα για την ικανότητά τους να προσθέτουν και να απελευθερώνουν αναστρέψιμα στοιχειακό οξυγόνο. Αυτές οι ενώσεις, σε κάποιο βαθμό, μπορούν να θεωρηθούν ως υποκατάστατα της αιμοσφαιρίνης.
Μία από τις αλλοτροπικές τροποποιήσεις του οξυγόνου είναι όζο Ο 3. Στις ιδιότητές του, το όζον είναι πολύ διαφορετικό από το οξυγόνο O2 - έχει υψηλότερα σημεία τήξης και βρασμού και έχει μια πικάντικη οσμή (εξ ου και το όνομά του).
Ο σχηματισμός όζοντος από το οξυγόνο συνοδεύεται από την απορρόφηση ενέργειας:
3О 2 ⇄2О 3,
Το όζον παράγεται από τη δράση μιας ηλεκτρικής εκκένωσης στο οξυγόνο. Το όζον σχηματίζεται από το O 2 και υπό την επίδραση της υπεριώδους ακτινοβολίας. Επομένως, όταν λειτουργούν οι βακτηριοκτόνοι και οι φυσιοθεραπευτικοί λαμπτήρες υπεριώδους ακτινοβολίας, γίνεται αισθητή η μυρωδιά του όζοντος.
Το όζον είναι ο ισχυρότερος οξειδωτικός παράγοντας. Οξειδώνει μέταλλα, αντιδρά βίαια με οργανικές ουσίες και σε χαμηλές θερμοκρασίες οξειδώνει ενώσεις με τις οποίες το οξυγόνο δεν αντιδρά:
O 3 + 2Ag = Ag 2 O + O 2
РbS + 4О 3 = РbSO 4 + 4O 2
Μια πολύ γνωστή ποιοτική αντίδραση είναι:
2KI + O 3 + H 2 O = I 2 + 2KON + O 2
Η οξειδωτική δράση του όζοντος στις οργανικές ουσίες σχετίζεται με το σχηματισμό ριζών:
RН + О 3 → RО 2 ∙ + ΑΥΤΟΣ ∙
Οι ρίζες ξεκινούν ριζικές αλυσιδωτές αντιδράσεις με βιοοργανικά μόρια - λιπίδια, πρωτεΐνες, DNA. Τέτοιες αντιδράσεις οδηγούν σε κυτταρική βλάβη και θάνατο. Συγκεκριμένα, το όζον σκοτώνει τους μικροοργανισμούς που περιέχονται στον αέρα και το νερό. Αυτή είναι η βάση για τη χρήση του όζοντος για την αποστείρωση του πόσιμου νερού και του νερού της πισίνας.
Χημικές ιδιότητες θειούχων ενώσεων.Στις ιδιότητές του, το θείο είναι κοντά στο οξυγόνο. Αλλά σε αντίθεση με αυτό, εμφανίζει σε ενώσεις όχι μόνο την κατάσταση οξείδωσης -2, αλλά και θετικές καταστάσεις οξείδωσης +2, +4 και +6. Το θείο, όπως και το οξυγόνο, χαρακτηρίζεται από αλλοτροπία - την ύπαρξη αρκετών στοιχειωδών ουσιών - ορθορομβικό, μονοκλινικό, πλαστικό θείο. Λόγω της χαμηλότερης ηλεκτραρνητικότητάς του σε σύγκριση με το οξυγόνο, η ικανότητα σχηματισμού δεσμών υδρογόνου στο θείο είναι λιγότερο έντονη. Το θείο χαρακτηρίζεται από το σχηματισμό σταθερών πολυμερών ομοαλυσίδων που έχουν σχήμα ζιγκ-ζαγκ.
Ο σχηματισμός ομοαλυσίδων από άτομα θείου είναι επίσης χαρακτηριστικός των ενώσεων του, οι οποίες παίζουν σημαντικό βιολογικό ρόλο στις διαδικασίες της ζωής. Έτσι, στα μόρια του αμινοξέος κυστίνη υπάρχει μια δισουλφιδική γέφυρα -S-S-:
Αυτό το αμινοξύ παίζει σημαντικό ρόλο στο σχηματισμό πρωτεϊνών και πεπτιδίων. Χάρη στον δισουλφιδικό δεσμό S-S, οι πολυπεπτιδικές αλυσίδες συγκρατούνται μεταξύ τους (δισουλφιδική γέφυρα).
Χαρακτηριστικό του θείου είναι ο σχηματισμός μιας ομάδας θειόλης υδρόθειου (σουλφυδρυλίου) -SH, η οποία υπάρχει στο αμινοξύ κυστεΐνη, πρωτεΐνες και ένζυμα.
Το αμινοξύ μεθειονίνη είναι πολύ σημαντικό βιολογικά.
Ο δότης των μεθυλομάδων σε ζωντανούς οργανισμούς είναι η S-αδενοσυλμεθειονίνη Ad-S-CH 3 - μια ενεργοποιημένη μορφή μεθειονίνης στην οποία η μεθυλομάδα συνδέεται μέσω S με την αδενίνη Ad. Η μεθυλομάδα της μεθειονίνης στις διεργασίες βιοσύνθεσης μεταφέρεται σε διάφορους αποδέκτες μεθυλομάδων RH:
Ad-S-CH 3 + RN → Ad-SN + R-CH 3
Το θείο είναι αρκετά διαδεδομένο στη Γη (0,03%). Υπάρχει στη φύση με τη μορφή θειούχων (ZnS, HgS, PbS κ.λπ.) και θειικών (Na 2 SO 4 ∙10H 2 O, CaSO 4 ∙2H 2 O, κ.λπ.) ορυκτών, καθώς και στα αυτοφυή κατάσταση. Η καταβυθισμένη σκόνη θείου χρησιμοποιείται εξωτερικά με τη μορφή αλοιφών (5-10-20%) και σκονών στη θεραπεία δερματικών παθήσεων (σμηγματόρροια, ψωρίαση). Το σώμα παράγει προϊόντα οξείδωσης θείου - πολυθειονικά οξέα με γενικό τύπο H 2 S x O 6 ( x = 3-6)
S + O 2 → H 2 S x O 6
Το θείο είναι ένα αρκετά αντιδραστικό αμέταλλο. Ακόμη και με ελαφρά θέρμανση, οξειδώνει πολλές απλές ουσίες, αλλά η ίδια οξειδώνεται εύκολα από το οξυγόνο και τα αλογόνα (οξειδοαναγωγική δυαδικότητα).
Το θείο εμφανίζει κατάσταση οξείδωσης -2 στο υδρόθειο και στα παράγωγά του - σουλφίδια.
Υδρόθειο (διυδρόθειο)συναντάται συχνά στη φύση. Περιέχεται στα λεγόμενα θειούχα μεταλλικά νερά. Είναι ένα άχρωμο αέριο με δυσάρεστη οσμή. Σχηματίζεται κατά την αποσύνθεση φυτικών και, ειδικότερα, ζωικών υπολειμμάτων υπό την επίδραση μικροοργανισμών. Ορισμένα φωτοσυνθετικά βακτήρια, όπως τα βακτήρια του πράσινου θείου, χρησιμοποιούν διυδροθείο ως δότη υδρογόνου. Αυτά τα βακτήρια, αντί για οξυγόνο O2, παράγουν στοιχειακό θείο - προϊόν της οξείδωσης του H2S.
Το δισόθειο είναι μια πολύ τοξική ουσία, καθώς είναι αναστολέας του ενζύμου οξειδάση του κυτοχρώματος, ενός μεταφορέα ηλεκτρονίων στην αναπνευστική αλυσίδα. Εμποδίζει τη μεταφορά ηλεκτρονίων από την οξειδάση του κυτοχρώματος στο οξυγόνο O2.
Υδατικά διαλύματα H 2 S δίνουν ελαφρά όξινη αντίδραση στη λακκούβα. Ο ιονισμός γίνεται σε δύο στάδια:
Н 2 S ⇄ Н + + НS - (Στάδιο Ι)
NS - ⇄ N + + S 2- (II στάδιο)
Το υδρόθειο οξύ είναι πολύ αδύναμο. Επομένως, ο ιοντισμός δεύτερου σταδίου συμβαίνει μόνο σε πολύ αραιά διαλύματα.
Τα άλατα του υδροσουλφιδικού οξέος ονομάζονται σουλφίδια.Μόνο σουλφίδια αλκαλίων, μετάλλων αλκαλικών γαιών και αμμωνίου είναι διαλυτά στο νερό. Τα όξινα άλατα - υδροσουλφίδια E + HS και E 2+ (HS) 2 - είναι γνωστά μόνο για μέταλλα αλκαλίων και αλκαλικών γαιών
Όντας άλατα ενός ασθενούς οξέος, τα σουλφίδια υφίστανται υδρόλυση. Η υδρόλυση των θειούχων κατιόντων μετάλλων πολλαπλά φορτισμένων (Al 3+, Cr 3+ κ.λπ.) συχνά ολοκληρώνεται και είναι πρακτικά μη αναστρέψιμη.
Τα σουλφίδια, ιδιαίτερα το υδρόθειο, είναι ισχυροί αναγωγικοί παράγοντες. Ανάλογα με τις συνθήκες, μπορούν να οξειδωθούν σε S, SO 2 ή H 2 SO 4:
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O (στον αέρα)
2H 2 S + O 2 = 2H 2 O + 2S (στον αέρα)
3H 2 S + 4HClO 3 = 3H 2 SO 4 + 4HCl (σε διάλυμα)
Ορισμένες πρωτεΐνες που περιέχουν κυστεΐνη HSCH 2 CH(NH 2) COOH και ένα σημαντικό συνένζυμο μεταβολίτη Α, με ομάδες υδρόθειου (θειόλης) -SH, συμπεριφέρονται σε έναν αριθμό αντιδράσεων ως βιοοργανικά παράγωγα του διυδροθείου. Πρωτεΐνες που περιέχουν κυστεΐνη, καθώς και δισόθειο, μπορούν να οξειδωθούν με ιώδιο. Με τη βοήθεια μιας δισουλφιδικής γέφυρας που σχηματίζεται κατά την οξείδωση των ομάδων θειόλης, υπολείμματα κυστεΐνης πολυπεπτιδικών αλυσίδων συνδέουν αυτές τις αλυσίδες με διασταυρούμενη σύνδεση (σχηματίζεται σταυροδεσμός).
Πολλά ένζυμα E-SH που περιέχουν θείο δηλητηριάζονται μη αναστρέψιμα από ιόντα βαρέων μετάλλων, όπως Cu 2+ ή Ag+. Αυτά τα ιόντα μπλοκάρουν τις ομάδες θειόλης για να σχηματίσουν μερκαπτάνες, βιοοργανικά ανάλογα σουλφιδίων:
E-SН + Ag + → E-S-Аg + H +
Ως αποτέλεσμα, το ένζυμο χάνει τη δραστηριότητα. Η συγγένεια των ιόντων Ag + για τις ομάδες θειόλης είναι τόσο υψηλή που το AgNO 3 μπορεί να χρησιμοποιηθεί για τον ποσοτικό προσδιορισμό των ομάδων -SH με τιτλοδότηση.
Οξείδιο του θείου(IV).Το SO 2 είναι ένα όξινο οξείδιο. Λαμβάνεται με καύση στοιχειακού θείου σε οξυγόνο ή ψήσιμο πυρίτη FeS 2:
S + O 2 = SO 2
4FеS 2 + 11О 2 = 2Fe 2 О 3 + 8SO 2
SO 2 - αέριο με αποπνικτική οσμή. πολύ δηλητηριώδες. Όταν το SO 2 διαλύεται στο νερό, σχηματίζεται θειώδες οξύ H 2 SO 3 . Αυτό το οξύ είναι μέτριας ισχύος. Το θειικό οξύ, ως διβασικό, σχηματίζει δύο τύπους αλάτων: μεσαίο - θειώδη(Na 2 SO 3, K 2 SO 3, κ.λπ.) και όξινο - υδροθειώδη(NaHSO 3, KHSO 3, κ.λπ.). Μόνο άλατα αλκαλιμετάλλων και υδροθειωδών του τύπου Ε 2+ (HSO 3) 2 είναι διαλυτά στο νερό, όπου το Ε είναι στοιχεία διαφόρων ομάδων.
Το οξείδιο SO2, το οξύ H2SO3 και τα άλατά του χαρακτηρίζονται από δυαδικότητα οξειδοαναγωγής, καθώς το θείο σε αυτές τις ενώσεις έχει μια ενδιάμεση κατάσταση οξείδωσης +4:
2Na 2 SO 3 + O 2 = 2Na 2 SO 4
SO 2 + 2H 2 S = 3S° + 2H 2 O
Ωστόσο, κυριαρχούν οι αναγωγικές ιδιότητες των ενώσεων θείου (IV). Έτσι, τα θειώδη σε διαλύματα οξειδώνονται ακόμη και από το διοοξυγόνο στον αέρα σε θερμοκρασία δωματίου.
Στα ανώτερα ζώα, το οξείδιο του SO 2 δρα κυρίως ως ερεθιστικό στη βλεννογόνο μεμβράνη της αναπνευστικής οδού. Αυτό το αέριο είναι επίσης τοξικό για τα φυτά. Σε βιομηχανικές περιοχές όπου καίγεται πολύς άνθρακας που περιέχει μικρές ποσότητες ενώσεων θείου, απελευθερώνεται διοξείδιο του θείου στην ατμόσφαιρα. Διαλύοντας στην υγρασία των φύλλων, το SO 2 σχηματίζει ένα διάλυμα θειικού οξέος, το οποίο, με τη σειρά του, οξειδώνεται σε θειικό οξύ H 2 SO 4:
SO 2 + H 2 O = H 2 SO 3
2H 2 SO 3 + O 2 = 2H 2 SO 4
Η ατμοσφαιρική υγρασία με διαλυμένο SO 2 και H 2 SO 4 συχνά πέφτει με τη μορφή όξινης βροχής, οδηγώντας στο θάνατο της βλάστησης.
Όταν θερμαίνεται ένα διάλυμα Na 2 SO 3 με σκόνη θείου, θειοθειικό νάτριο:
Na 2 SO 3 + S = Na 2 S 2 O 3
Από το διάλυμα απελευθερώνεται κρυσταλλικό ένυδρο Na 2 S 2 O 3 ∙5H 2 O Θειοθειικό νάτριο - άλας θειοθειικό οξύ H 2 S 2 O 3 .
Το θειοθειικό οξύ είναι πολύ ασταθές και αποσυντίθεται σε H 2 O, SO 2 και S. Το θειοθειικό νάτριο Na 2 S 2 O 3 ∙5H 2 O χρησιμοποιείται στην ιατρική πρακτική ως αντιτοξικό, αντιφλεγμονώδες και απευαισθητοποιητικό παράγοντα. Ως αντιτοξικός παράγοντας, το θειοθειικό νάτριο χρησιμοποιείται για δηλητηρίαση με ενώσεις υδραργύρου, μόλυβδο, υδροκυανικό οξύ και τα άλατά του. Ο μηχανισμός δράσης του φαρμάκου σχετίζεται προφανώς με την οξείδωση του θειοθειικού ιόντος σε θειώδες ιόν και στοιχειακό θείο:
S 2 O 3 2- → SO 3 2- + S°
Τα ιόντα μολύβδου και υδραργύρου που εισέρχονται στο σώμα με τροφή ή αέρα σχηματίζουν κακώς διαλυτά μη τοξικά θειώδη:
Рb 2+ + SO 3 2- = РbSO 3
Τα κυανιούχα ιόντα αντιδρούν με το στοιχειακό θείο, σχηματίζοντας λιγότερο τοξικά θειοκυανικά:
СN - + S° = NСS -
Το θειοθειικό νάτριο χρησιμοποιείται επίσης για τη θεραπεία της ψώρας. Αφού τρίψετε το διάλυμα στο δέρμα, επαναλάβετε το τρίψιμο με διάλυμα HCl 6%. Ως αποτέλεσμα της αντίδρασης με HCl, το θειοθειικό νάτριο αποσυντίθεται σε θείο και διοξείδιο του θείου:
Na 2 S 2 O 3 + 2HCl = 2NaCl + SO 2 + S + H 2 O
που έχουν επιζήμια επίδραση στα ακάρεα της ψώρας.
Οξείδιο θείο (VI)Το SO 3 είναι ένα πτητικό υγρό. Όταν αλληλεπιδρά με το νερό, το SO 3 σχηματίζει θειικό οξύ:
SO 3 + H 2 O = H 2 SO 4
Η δομή των μορίων του θειικού οξέος αντιστοιχεί στο θείο sp 3 -υβριδική κατάσταση.
Το θειικό οξύ είναι ένα ισχυρό διβασικό οξύ. Στο πρώτο στάδιο, ιονίζεται σχεδόν πλήρως:
H 2 SO 4 ⇄ H + + HSO 4 - ,
Ο ιονισμός στο δεύτερο στάδιο συμβαίνει σε μικρότερο βαθμό:
НSO 4 - ⇄ Н + + SO 4 2- ,
Το πυκνό θειικό οξύ είναι ένας ισχυρός οξειδωτικός παράγοντας. Οξειδώνει μέταλλα και αμέταλλα. Τυπικά, το προϊόν της αναγωγής του είναι SO2, αν και ανάλογα με τις συνθήκες αντίδρασης (δραστηριότητα μετάλλου, θερμοκρασία, συγκέντρωση οξέος), μπορούν να ληφθούν και άλλα προϊόντα (S, H2S).
Όντας διβασικό οξύ, το H 2 SO 4 σχηματίζει δύο τύπους αλάτων: μεσαίο - θειικά(Na 2 SO 4, κ.λπ.) και όξινο - υδροθειικά(NaHSO 4, KHSO 4, κ.λπ.). Τα περισσότερα θειικά είναι πολύ διαλυτά στο νερό Πολλά θειικά άλατα απομονώνονται από διαλύματα με τη μορφή κρυσταλλικών ένυδρων: FeSO 4 ∙7H 2 O, CuSO 4 ∙5H 2 O. Τα πρακτικά αδιάλυτα θειικά περιλαμβάνουν BaSO 4, SrSO 4 και PbSO 4. Ελαφρώς διαλυτό θειικό ασβέστιο CaSO 4 . Το θειικό βάριο είναι αδιάλυτο όχι μόνο στο νερό, αλλά και σε αραιά οξέα.
Στην ιατρική πρακτική, τα θειικά άλατα πολλών μετάλλων χρησιμοποιούνται ως φάρμακα: Na 2 SO 4 ∙10H 2 O - ως καθαρτικό, MgSO 4 ∙7H 2 O - για την υπέρταση, ως καθαρτικό και ως χολερετικό παράγοντα, θειικός χαλκός CuSO 4 ∙ 5H 2 O και ZnSO 4 ∙7H 2 O - ως αντισηπτικό, στυπτικό, εμετικό, θειικό βάριο BaSO 4 - ως σκιαγραφικό για εξέταση ακτίνων Χ του οισοφάγου και του στομάχου
Ενώσεις σεληνίου και τελλουρίου.Οι χημικές ιδιότητες του τελλουρίου και ιδιαίτερα του σεληνίου είναι παρόμοιες με το θείο. Ωστόσο, η ενίσχυση των μεταλλικών ιδιοτήτων των Se και Te αυξάνει την τάση τους να σχηματίζουν ισχυρότερους ιοντικούς δεσμούς. Η ομοιότητα των φυσικοχημικών χαρακτηριστικών: ακτίνες ιόντων E 2-, αριθμοί συντονισμού (3, 4) - καθορίζει την εναλλαξιμότητα του σεληνίου και του θείου στις ενώσεις. Έτσι, το σελήνιο μπορεί να αντικαταστήσει το θείο στα ενεργά κέντρα των ενζύμων. Η αντικατάσταση της ομάδας του υδρόθειου -SH με την ομάδα του υδροσεληνίου -SeH αλλάζει την πορεία των βιοχημικών διεργασιών στο σώμα. Το σελήνιο μπορεί να δράσει τόσο ως συνεργιστικό όσο και ως ανταγωνιστής του θείου.
Με το υδρογόνο, τα Se και Te σχηματίζουν παρόμοια με το H 2 S, πολύ δηλητηριώδη αέρια H 2 Se και H 2 Te. Το διυδροσεληνίδιο και το διυδροτελλουρίδιο είναι ισχυροί αναγωγικοί παράγοντες. Στη σειρά H 2 S-H 2 Se-H 2 Te, η αναγωγική δραστηριότητα αυξάνεται.
Για το H 2 Se απομονώνονται ως μέτρια άλατα - σεληνίδες(Na 2 Se, κ.λπ.), και όξινα άλατα - υδροσεληνίδια(NaHSe, κ.λπ.). Για το H 2 Te, είναι γνωστά μόνο μέτρια άλατα - τελουρίδες.
Οι ενώσεις Se (IV) και Te (IV) με οξυγόνο, σε αντίθεση με το SO 2, είναι στερεές κρυσταλλικές ουσίες SeO 2 και TeO 2.
Σεληνώδες οξύ H 2 SeO 3 και τα άλατά του Σεληνίτες,Για παράδειγμα, το Na 2 SeO 3 είναι οξειδωτικά μέσα μέσης ισχύος. Έτσι, σε υδατικά διαλύματα ανάγεται σε σελήνιο με αναγωγικούς παράγοντες όπως SO 2, H 2 S, HI, κ.λπ.:
H 2 SeO 3 + 2SO 2 + H 2 O = Se + 2H 2 SO 4
Προφανώς, η ευκολία αναγωγής των σεληνιτών στη στοιχειακή κατάσταση καθορίζει τον σχηματισμό βιολογικά ενεργών ενώσεων που περιέχουν σελήνιο στο σώμα, για παράδειγμα, σεληνοκυστεΐνη.
Το SeO 3 και το TeO 3 είναι όξινα οξείδια. Οξύγονο οξέα Se (VI) και Te (VI) - σελήνιο H 2 SeO 4 και τελλούριο H 6 TeO 6 - κρυσταλλικές ουσίες με ισχυρές οξειδωτικές ιδιότητες. Τα άλατα αυτών των οξέων ονομάζονται αντίστοιχα σεληνικάΚαι Τελουράτες.
Στους ζωντανούς οργανισμούς, τα σεληνικά και τα θειικά είναι ανταγωνιστές. Έτσι, η εισαγωγή θειικών αλάτων οδηγεί στην απομάκρυνση της περίσσειας των ενώσεων που περιέχουν σελήνιο από το σώμα.
Διαφάνεια 2
Το θείο, το σελήνιο και το τελλούριο είναι στοιχεία της κύριας υποομάδας της ομάδας VI, μέλη της οικογένειας των χαλκογόνων.
Διαφάνεια 3
Θείο
Το θείο είναι μια από τις ουσίες που είναι γνωστές στην ανθρωπότητα από αμνημονεύτων χρόνων. Ακόμη και οι αρχαίοι Έλληνες και οι Ρωμαίοι βρήκαν διάφορες πρακτικές χρήσεις του. Κομμάτια αυτοφυούς θείου χρησιμοποιήθηκαν για την εκτέλεση του τελετουργικού της αποβολής των κακών πνευμάτων.
Διαφάνεια 4
Τελλούριο
Σε μια από τις περιοχές της Αυστρίας, που ονομαζόταν Semigorye, ανακαλύφθηκε ένα παράξενο γαλαζωπόλευκο μετάλλευμα τον 18ο αιώνα.
Διαφάνεια 5
σελήνιο
Το σελήνιο είναι ένα από τα στοιχεία που γνώριζε ο άνθρωπος ακόμη και πριν την επίσημη ανακάλυψή του. Αυτό το χημικό στοιχείο καλύφθηκε πολύ καλά από άλλα χημικά στοιχεία που ήταν παρόμοια σε χαρακτηριστικά με το σελήνιο. Τα κύρια στοιχεία που το κάλυπταν ήταν το θείο και το τελλούριο.
Διαφάνεια 6
Παραλαβή
Η μέθοδος οξείδωσης υδρόθειου σε στοιχειακό θείο αναπτύχθηκε για πρώτη φορά στη Μεγάλη Βρετανία, όπου έμαθαν να λαμβάνουν σημαντικές ποσότητες θείου από το Na2CO3 που απομένει μετά την παραγωγή σόδας χρησιμοποιώντας τη μέθοδο του Γάλλου χημικού N. Leblanc του θειούχου ασβεστίου CaS. Η μέθοδος του Leblanc βασίζεται στην αναγωγή του θειικού νατρίου με άνθρακα παρουσία ασβεστόλιθου CaCO3. Na2SO4 + 2C = Na2S + 2CO2; Na2S + CaCO3 = Na2CO3 + CaS
Διαφάνεια 7
Στη συνέχεια η σόδα ξεπλένεται με νερό και το υδατικό εναιώρημα του κακώς διαλυτού θειούχου ασβεστίου επεξεργάζεται με διοξείδιο του άνθρακα
CaS + CO2 + H2O = CaCO3 + H2S Το προκύπτον υδρόθειο H2S αναμεμειγμένο με αέρα περνάει σε κλίβανο πάνω από ένα στρώμα καταλύτη. Στην περίπτωση αυτή, λόγω της ατελούς οξείδωσης του υδρόθειου, σχηματίζεται θείο 2H2S + O2 = 2H2O + 2S
Διαφάνεια 8
Όταν θερμαίνεται με υδροχλωρικό οξύ, το σεληνικό οξύ ανάγεται σε σεληνικό οξύ. Στη συνέχεια, διοξείδιο του θείου SO2 H2SeO3 + 2SO2 + H2O = Se + 2H2SO4 διέρχεται από το προκύπτον διάλυμα σεληνικού οξέος.Για καθαρισμό, το σελήνιο στη συνέχεια καίγεται σε οξυγόνο κορεσμένο με ατμούς ατμίζοντος νιτρικού οξέος HNO3. Σε αυτή την περίπτωση, το καθαρό διοξείδιο του σεληνίου SeO2 εξαχνώνεται. Από διάλυμα SeO2 σε νερό, μετά την προσθήκη υδροχλωρικού οξέος, το σελήνιο κατακρημνίζεται και πάλι με διέλευση διοξειδίου του θείου από το διάλυμα.
Διαφάνεια 9
Για να διαχωριστεί το Te από τις λάσπες, πυροσυσσωματώνονται με σόδα και ακολουθεί έκπλυση. Το Te περνά σε αλκαλικό διάλυμα, από το οποίο, κατά την εξουδετέρωση, καθιζάνει με τη μορφή TeO2 Na2TeO3+2HC=TeO2+2NaCl. Για τον καθαρισμό του τελλουρίου από S και Se, χρησιμοποιείται η ικανότητά του, υπό τη δράση ενός αναγωγικού παράγοντα (Al) σε ένα αλκαλικό μέσο, να μετατρέπεται σε διαλυτό διτελλουρίτιο δινάτριο Na2Te2 6Te+2Al+8NaOH=3Na2Te2+2Na.
Διαφάνεια 10
Για να κατακρημνιστεί το τελλούριο, διέρχεται αέρας ή οξυγόνο από το διάλυμα: 2Na2Te2+2H2O+O2=4Te+4NaOH. Για να ληφθεί τελλούριο ειδικής καθαρότητας, χλωριώνεται: Te+2Cl2=TeCl4. Το προκύπτον τετραχλωρίδιο καθαρίζεται με απόσταξη ή διόρθωση. Στη συνέχεια το τετραχλωρίδιο υδρολύεται με νερό: TeCl4 + 2H2O = TeO2Ї + 4HCl, και το TeO2 που προκύπτει ανάγεται με υδρογόνο: TeO2 + 4H2 = Te + 2H2O.
Διαφάνεια 11
Φυσικές ιδιότητες
Διαφάνεια 12
Χημικές ιδιότητες
Στον αέρα, το θείο καίγεται, σχηματίζοντας διοξείδιο του θείου - ένα άχρωμο αέριο με έντονη οσμή: S + O2 → SO2 Οι αναγωγικές ιδιότητες του θείου εκδηλώνονται στις αντιδράσεις του θείου με άλλα αμέταλλα, αλλά σε θερμοκρασία δωματίου το θείο αντιδρά μόνο με το φθόριο : S + 3F2 → SF6
Διαφάνεια 13
Το τηγμένο θείο αντιδρά με το χλώριο, με πιθανό σχηματισμό δύο κατώτερων χλωριδίων 2S + Cl2 → S2Cl2 S + Cl2 → SCl2 Όταν θερμαίνεται, το θείο αντιδρά επίσης με το φώσφορο, σχηματίζοντας ένα μείγμα θειούχων φωσφόρου, μεταξύ των οποίων είναι το υψηλότερο θειούχο P2 +S5: 2P → P2S2 Επιπλέον, όταν θερμαίνεται, το θείο αντιδρά με υδρογόνο, άνθρακα, πυρίτιο: S + H2 → H2S (υδρόθειο) C + 2S → CS2 (δισουλφίδιο του άνθρακα)
Διαφάνεια 14
Από τις σύνθετες ουσίες, πρέπει πρώτα να σημειώσουμε την αντίδραση του θείου με τηγμένο αλκάλιο, στην οποία το θείο είναι σε δυσανάλογη αναλογία με το χλώριο: 3S + 6KOH → K2SO3 + 2K2S + 3H2O Με πυκνά οξειδωτικά οξέα, το θείο αντιδρά μόνο με παρατεταμένη θέρμανση: S+ 6HNO3 (συμπ.) → H2SO4 + 6NO2 + 2H2O S+ 2 H2SO4 (συμπ.) → 3SO2 + 2H2O
Διαφάνεια 15
Στους 100–160°C οξειδώνεται από το νερό: Te+2H2O= TeO2+2H2 Όταν βράζεται σε αλκαλικά διαλύματα, το τελλούριο δυσανάλογα σχηματίζει τελλουρίδιο και τελλουρίτη: 8Te+6KOH=2K2Te+ K2TeO3+3H2O.
Διαφάνεια 16
Το αραιό HNO3 οξειδώνει το Te σε τελλουρικό οξύ H2TeO3: 3Te+4HNO3+H2O=3H2TeO3+4NO. Ισχυροί οξειδωτικοί παράγοντες (HClO3, KMnO4) οξειδώνουν το Te σε ασθενές τελλουρικό οξύ H6TeO6: Te+HClO3+3H2O=HCl+H6TeO6. Οι ενώσεις του τελλουρίου (+2) είναι ασταθείς και επιρρεπείς σε δυσαναλογία: 2TeCl2=TeCl4+Te.
Διαφάνεια 17
Όταν θερμαίνεται στον αέρα, καίγεται για να σχηματίσει άχρωμο κρυσταλλικό SeO2: Se + O2 = SeO2. Αντιδρά με το νερό όταν θερμαίνεται: 3Se + 3H2O = 2H2Se + H2SeO3. Το σελήνιο αντιδρά όταν θερμαίνεται με νιτρικό οξύ για να σχηματίσει σεληνώδες οξύ H2SeO3: 3Se + 4HNO3 + H2O = 3H2SeO3 + 4NO.
Διαφάνεια 18
Όταν βράζεται σε αλκαλικά διαλύματα, το σελήνιο είναι δυσανάλογο: 3Se + 6KOH = K2SeO3 + 2K2Se + 3H2O. Εάν το σελήνιο βράσει σε αλκαλικό διάλυμα από το οποίο διέρχεται αέρας ή οξυγόνο, τότε σχηματίζονται ερυθροκαφέ διαλύματα που περιέχουν πολυσεληνίδια: K2Se + 3Se = K2Se4
Η κύρια υποομάδα της ομάδας VI του περιοδικού πίνακα περιλαμβάνει το οξυγόνο, το θείο, το σελήνιο, το τελλούριο και το πολώνιο. Οι μη μεταλλικές ιδιότητες των στοιχείων της ομάδας VI-A είναι λιγότερο έντονες από εκείνες των αλογόνων. Τα ηλεκτρόνια σθένους τους είναι ns 2 np 4 .
Δεδομένου ότι τα άτομα των στοιχείων της ομάδας VI-A περιέχουν έξι ηλεκτρόνια στο εξωτερικό στρώμα, τείνουν να γεμίζουν το εξωτερικό ενεργειακό επίπεδο με ηλεκτρόνια και χαρακτηρίζονται από το σχηματισμό ανιόντων Ε2. Τα άτομα των υπό εξέταση στοιχείων (εκτός από το πολώνιο) δεν είναι επιρρεπή στο σχηματισμό κατιόντων.
Το οξυγόνο και το θείο είναι τυπικά αμέταλλα, με το οξυγόνο να είναι ένα από τα πιο ηλεκτραρνητικά στοιχεία (δεύτερο μόνο μετά το φθόριο). Το πολώνιο είναι ένα ασημί-λευκό μέταλλο, που θυμίζει μόλυβδο σε φυσικές ιδιότητες και σε ηλεκτροχημικές ιδιότητες - ευγενή μέταλλα. Το σελήνιο και το τελλούριο καταλαμβάνουν μια ενδιάμεση θέση μεταξύ μετάλλων και μη μετάλλων· είναι ημιαγωγοί. Όσον αφορά τις χημικές ιδιότητες, είναι πιο κοντά στα αμέταλλα. Το οξυγόνο, το θείο, το σελήνιο και το τελλούριο ομαδοποιούνται ως «χαλκογόνα», που μεταφράζεται από τα ελληνικά σημαίνει «δημιουργία μεταλλευμάτων». Αυτά τα στοιχεία βρίσκονται σε πολλά μεταλλεύματα. Από το οξυγόνο μέχρι το τελλούριο, η περιεκτικότητα σε στοιχεία στη Γη μειώνεται απότομα. Το πολώνιο δεν έχει σταθερά ισότοπα και βρίσκεται στα μεταλλεύματα ουρανίου και θορίου, ως ένα από τα προϊόντα διάσπασης του ραδιενεργού ουρανίου.
Στις ιδιότητές τους, το οξυγόνο και το θείο διαφέρουν έντονα μεταξύ τους, επειδή Τα ηλεκτρονιακά κελύφη τους του προηγούμενου ενεργειακού επιπέδου είναι κατασκευασμένα διαφορετικά. Το τελλούριο και το πολώνιο έχουν την ίδια δομή του εξωτερικού ενεργειακού επιπέδου (στρώμα σθένους) και του προτελευταίου ενεργειακού επιπέδου, επομένως μοιάζουν περισσότερο στις ιδιότητές τους.
Το οξυγόνο είναι ένα χημικά ενεργό αμέταλλο και είναι το ελαφρύτερο στοιχείο από την ομάδα των χαλκογόνων. Η απλή ουσία οξυγόνο υπό κανονικές συνθήκες είναι ένα αέριο χωρίς χρώμα, γεύση ή οσμή, το μόριο του οποίου αποτελείται από δύο άτομα οξυγόνου (τύπος O 2), και γι' αυτό ονομάζεται και διοξυγόνο. Το υγρό οξυγόνο έχει ανοιχτό μπλε χρώμα και το στερεό οξυγόνο είναι ανοιχτόχρωμοι κρύσταλλοι. Υπάρχουν και άλλες αλλοτροπικές μορφές οξυγόνου, για παράδειγμα, το όζον - υπό κανονικές συνθήκες, ένα μπλε αέριο με συγκεκριμένη οσμή, το μόριο του οποίου αποτελείται από τρία άτομα οξυγόνου (τύπος O3 Η λέξη οξυγόνο (ονομαζόμενη επίσης «διάλυμα οξέος» στις αρχές του 19ου αιώνα) οφείλει την εμφάνισή της στη ρωσική γλώσσα σε κάποιο βαθμό στον M.V. Lomonosov, ο οποίος εισήγαγε τη λέξη «οξύ», μαζί με άλλους νεολογισμούς. Έτσι, η λέξη «οξυγόνο», με τη σειρά της, ήταν μια ανίχνευση του όρου «οξυγόνο» (γαλλ. οξυγίνη), που προτάθηκε από τον Α. Λαβουαζιέ (από τα αρχαία ελληνικά ?oet - «ξινός» και gennshch - «γεννώ»), που μεταφράζεται ως «οξύ που παράγει», που σχετίζεται με την αρχική του σημασία – «οξύ», που προηγουμένως σήμαινε ουσίες που ονομάζονταν οξείδια σύμφωνα με τη σύγχρονη διεθνή ονοματολογία. Το οξυγόνο είναι το πιο κοινό στοιχείο στον φλοιό της γης· το μερίδιό του (σε διάφορες ενώσεις, κυρίως πυριτικά) αντιπροσωπεύει περίπου το 47% της μάζας του στερεού φλοιού της γης. Στην ατμόσφαιρα η περιεκτικότητα σε ελεύθερο οξυγόνο είναι 20,95% κατ' όγκο και 23,10% κατά μάζα (περίπου 1015 τόνοι) Επί του παρόντος, στη βιομηχανία, το οξυγόνο λαμβάνεται από τον αέρα. Η κύρια βιομηχανική μέθοδος για την παραγωγή οξυγόνου είναι η κρυογονική ανόρθωση. Οι μονάδες οξυγόνου που λειτουργούν με βάση την τεχνολογία μεμβρανών είναι επίσης πολύ γνωστές και χρησιμοποιούνται με επιτυχία στη βιομηχανία.
Τα εργαστήρια χρησιμοποιούν βιομηχανικά παραγόμενο οξυγόνο, το οποίο παρέχεται σε χαλύβδινους κυλίνδρους υπό πίεση περίπου 15 MPa.
Μικρές ποσότητες οξυγόνου μπορούν να ληφθούν με θέρμανση του υπερμαγγανικού καλίου KMnO4:
Χρησιμοποιείται επίσης η αντίδραση καταλυτικής αποσύνθεσης του υπεροξειδίου του υδρογόνου H2O2 παρουσία οξειδίου του μαγγανίου (IV):
Το οξυγόνο μπορεί να ληφθεί με την καταλυτική αποσύνθεση του χλωρικού καλίου (άλας Berthollet) KClO 3:
Οι εργαστηριακές μέθοδοι για την παραγωγή οξυγόνου περιλαμβάνουν τη μέθοδο ηλεκτρόλυσης υδατικών διαλυμάτων αλκαλίων, καθώς και την αποσύνθεση του οξειδίου του υδραργύρου (II) (σε t = 100 °C):
Στα υποβρύχια συνήθως λαμβάνεται με την αντίδραση υπεροξειδίου του νατρίου και διοξειδίου του άνθρακα που εκπνέεται από τον άνθρωπο:
Ισχυρός οξειδωτικός παράγοντας, αλληλεπιδρά με όλα σχεδόν τα στοιχεία, σχηματίζοντας οξείδια. Κατάσταση οξείδωσης;2. Κατά κανόνα, η αντίδραση οξείδωσης προχωρά με την απελευθέρωση θερμότητας και επιταχύνεται με την αύξηση της θερμοκρασίας. Παράδειγμα αντιδράσεων που συμβαίνουν σε θερμοκρασία δωματίου:
Οξειδώνει ενώσεις που περιέχουν στοιχεία με κατάσταση οξείδωσης μικρότερη από τη μέγιστη:
Οξειδώνει τις περισσότερες οργανικές ενώσεις:
Υπό ορισμένες συνθήκες, είναι δυνατό να πραγματοποιηθεί ήπια οξείδωση μιας οργανικής ένωσης:
Το οξυγόνο αντιδρά άμεσα (υπό κανονικές συνθήκες, με θέρμανση και/ή παρουσία καταλυτών) με όλες τις απλές ουσίες εκτός από το Au και τα αδρανή αέρια (He, Ne, Ar, Kr, Xe, Rn). αντιδράσεις με αλογόνα συμβαίνουν υπό την επίδραση ηλεκτρικής εκκένωσης ή υπεριώδους ακτινοβολίας. Οξείδια χρυσού και βαρέα αδρανή αέρια (Xe, Rn) ελήφθησαν έμμεσα. Σε όλες τις ενώσεις δύο στοιχείων του οξυγόνου με άλλα στοιχεία, το οξυγόνο παίζει το ρόλο ενός οξειδωτικού παράγοντα, εκτός από τις ενώσεις με φθόριο.
Το οξυγόνο σχηματίζει υπεροξείδια με την κατάσταση οξείδωσης του ατόμου του οξυγόνου τυπικά ίση με;1.
Για παράδειγμα, τα υπεροξείδια παράγονται από την καύση αλκαλικών μετάλλων σε οξυγόνο:
Ορισμένα οξείδια απορροφούν οξυγόνο:
Σύμφωνα με τη θεωρία της καύσης που αναπτύχθηκε από τους A. N. Bach και K. O. Engler, η οξείδωση συμβαίνει σε δύο στάδια με το σχηματισμό μιας ενδιάμεσης ένωσης υπεροξειδίου. Αυτή η ενδιάμεση ένωση μπορεί να απομονωθεί, για παράδειγμα, όταν μια φλόγα καμένου υδρογόνου ψύχεται με πάγο, σχηματίζεται υπεροξείδιο του υδρογόνου μαζί με νερό:
Στα υπεροξείδια, το οξυγόνο τυπικά έχει μια κατάσταση οξείδωσης ~S, δηλαδή, ένα ηλεκτρόνιο ανά δύο άτομα οξυγόνου (ιόν Οδ2). Λαμβάνεται με αντίδραση υπεροξειδίων με οξυγόνο σε αυξημένη πίεση και θερμοκρασία:
Το κάλιο Κ, το ρουβίδιο Rb και το καίσιο Cs αντιδρούν με το οξυγόνο για να σχηματίσουν υπεροξείδια:
Τα ανόργανα οζονίδια περιέχουν το ιόν Οβ3 με την κατάσταση οξείδωσης του οξυγόνου τυπικά ίση με το 1/3. Λαμβάνεται από τη δράση του όζοντος σε υδροξείδια αλκαλικών μετάλλων:
Το θείο είναι στοιχείο της κύριας υποομάδας της ομάδας VI, της τρίτης περιόδου του περιοδικού πίνακα χημικών στοιχείων του D.I. Mendeleev, με ατομικό αριθμό 16. Εμφανίζει μη μεταλλικές ιδιότητες. Συμβολίζεται με το σύμβολο S (Λατινικό θείο). Στις ενώσεις υδρογόνου και οξυγόνου βρίσκεται σε διάφορα ιόντα και σχηματίζει πολλά οξέα και άλατα. Πολλά άλατα που περιέχουν θείο είναι ελάχιστα διαλυτά στο νερό. Το θείο είναι το δέκατο έκτο πιο άφθονο στοιχείο στον φλοιό της γης. Βρίσκεται σε ελεύθερη (γηγενή) κατάσταση και δεμένη μορφή.
Τα πιο σημαντικά φυσικά ορυκτά θείου: FeS 2 - σιδηροπυρίτης ή πυρίτης, ZnS - μείγμα ψευδαργύρου ή φαληρίτης (βουρτζίτης), PbS - λάμψη μολύβδου ή γαλήνης, HgS - κιννάβαρη, Sb 2 S 3 - στιβνίτης. Επιπλέον, το θείο υπάρχει στο πετρέλαιο, τον φυσικό άνθρακα, τα φυσικά αέρια και τον σχιστόλιθο. Το θείο είναι το έκτο πιο άφθονο στοιχείο στα φυσικά νερά· βρίσκεται κυρίως με τη μορφή θειικών ιόντων και προκαλεί τη «σταθερή» σκληρότητα του γλυκού νερού. Ένα ζωτικό στοιχείο για τους ανώτερους οργανισμούς, αναπόσπαστο μέρος πολλών πρωτεϊνών, συγκεντρώνεται στα μαλλιά. Η λέξη "θείο", γνωστή στην παλαιά ρωσική γλώσσα από τον 15ο αιώνα, είναι δανεισμένη από το παλιό σλαβικό "s?ra" - "θείο, ρητίνη", γενικά "εύφλεκτη ουσία, λίπος". Η ετυμολογία της λέξης δεν έχει διευκρινιστεί μέχρι σήμερα, αφού η αρχική κοινή σλαβική ονομασία της ουσίας έχει χαθεί και η λέξη έφτασε στη σύγχρονη ρωσική γλώσσα με παραμορφωμένη μορφή.
Σύμφωνα με τον Vasmer, το "θείο" ανάγεται στο λατ. sera -- «κερί» ή λατ. ορός -- «ορός».
Το λατινικό sulfur (προέρχεται από την εξελληνισμένη ορθογραφία του ετυμολογικού sulpur) προφανώς ανάγεται στην ινδοευρωπαϊκή ρίζα swelp - «καίγομαι». Στον αέρα, το θείο καίγεται, σχηματίζοντας διοξείδιο του θείου - ένα άχρωμο αέριο με έντονη οσμή:
Χρησιμοποιώντας φασματική ανάλυση, διαπιστώθηκε ότι στην πραγματικότητα η διαδικασία οξείδωσης του θείου σε διοξείδιο είναι μια αλυσιδωτή αντίδραση και συμβαίνει με το σχηματισμό ενός αριθμού ενδιάμεσων προϊόντων: μονοξείδιο του θείου S 2 O 2, μοριακό θείο S 2, ελεύθερα άτομα θείου S και ελεύθερες ρίζες μονοξειδίου του θείου SO.
Οι αναγωγικές ιδιότητες του θείου εκδηλώνονται στις αντιδράσεις του θείου με άλλα αμέταλλα, ωστόσο, σε θερμοκρασία δωματίου, το θείο αντιδρά μόνο με το φθόριο.
Το τηγμένο θείο αντιδρά με το χλώριο και είναι δυνατός ο σχηματισμός δύο κατώτερων χλωριδίων (διχλωριούχου θείου και διθειοδιχλωριούχου).
Με περίσσεια θείου, σχηματίζονται επίσης διάφορα διχλωριούχα πολυθεία όπως το SnCl 2.
Όταν θερμαίνεται, το θείο αντιδρά επίσης με το φώσφορο, σχηματίζοντας ένα μείγμα θειούχων φωσφόρου, μεταξύ των οποίων είναι το υψηλότερο θειούχο P2S5:
Επιπλέον, όταν θερμαίνεται, το θείο αντιδρά με υδρογόνο, άνθρακα, πυρίτιο:
- (υδρόθειο)
- (δισουλφίδιο του άνθρακα)
Όταν θερμαίνεται, το θείο αλληλεπιδρά με πολλά μέταλλα, συχνά αρκετά βίαια. Μερικές φορές ένα μείγμα μετάλλου και θείου αναφλέγεται όταν αναφλέγεται. Αυτή η αλληλεπίδραση παράγει σουλφίδια:
Διαλύματα θειούχων μετάλλων αλκαλίων αντιδρούν με θείο για να σχηματίσουν πολυσουλφίδια:
Από τις σύνθετες ουσίες, αξιοσημείωτη πρώτα απ' όλα είναι η αντίδραση του θείου με τηγμένο αλκάλιο, στο οποίο το θείο είναι δυσανάλογα παρόμοιο με το χλώριο:
Το κράμα που προκύπτει ονομάζεται συκώτι θείου.
Το θείο αντιδρά με πυκνά οξειδωτικά οξέα (HNO 3, H 2 SO 4) μόνο με παρατεταμένη θέρμανση:
- (σύν.)
- (σύν.)
Καθώς η θερμοκρασία αυξάνεται στους ατμούς του θείου, συμβαίνουν αλλαγές στην ποσοτική μοριακή σύνθεση. Ο αριθμός των ατόμων σε ένα μόριο μειώνεται:
Στους 800--1400 °C οι ατμοί αποτελούνται κυρίως από διατομικό θείο:
Και στους 1700 °C το θείο γίνεται ατομικό:
Το θείο είναι ένα από τα βιογενή στοιχεία. Το θείο είναι μέρος ορισμένων αμινοξέων (κυστεΐνη, μεθειονίνη), βιταμίνες (βιοτίνη, θειαμίνη) και ένζυμα. Το θείο εμπλέκεται στο σχηματισμό της πρωτεϊνικής τριτοταγούς δομής (σχηματισμός δισουλφιδικών γεφυρών). Το θείο εμπλέκεται επίσης στη βακτηριακή φωτοσύνθεση (το θείο είναι μέρος της βακτηριοχλωροφύλλης και το υδρόθειο είναι πηγή υδρογόνου). Οι αντιδράσεις οξειδοαναγωγής του θείου είναι πηγή ενέργειας στη χημειοσύνθεση.
Ένα άτομο περιέχει περίπου 2 g θείου ανά 1 kg σωματικού βάρους
Το σελήνιο είναι ένα χημικό στοιχείο της 16ης ομάδας (σύμφωνα με την ξεπερασμένη ταξινόμηση - η κύρια υποομάδα της ομάδας VI), η 4η περίοδος στον περιοδικό πίνακα, έχει ατομικό αριθμό 34, που συμβολίζεται με το σύμβολο Se (λατ. Σελήνιο), ένα εύθραυστο , γυαλιστερό, μαύρο αμέταλλο (σταθερή αλλοτροπική μορφή, ασταθής μορφή - κιννάβαρο-κόκκινο). Αναφέρεται σε χαλκογόνα.
Το όνομα προέρχεται από τα ελληνικά. welUnz - Σελήνη. Το στοιχείο ονομάζεται έτσι λόγω του γεγονότος ότι στη φύση είναι ένας δορυφόρος του τελλουρίου, που είναι χημικά παρόμοιος με αυτό (που πήρε το όνομά του από τη Γη).Η περιεκτικότητα σε σελήνιο στον φλοιό της γης είναι περίπου 500 mg/t. Τα κύρια χαρακτηριστικά της γεωχημείας του σεληνίου στον φλοιό της γης καθορίζονται από την εγγύτητα της ιοντικής ακτίνας του με την ιοντική ακτίνα του θείου. Το σελήνιο σχηματίζει 37 μέταλλα, μεταξύ των οποίων πρέπει πρώτα να σημειωθεί ο ασαβαλίτης FeSe, ο κλαουσθαλίτης PbSe, ο τιμαννίτης HgSe, ο γουαναχουατίτης Bi 2 (Se, S) 3, ο χαστίτης CoSe 2, ο πλατινίτης PbBi2 (S, Se) 3, που σχετίζονται με διάφορα σουλφίδια, και μερικές φορές επίσης με κασιρίτη. Το εγγενές σελήνιο εντοπίζεται περιστασιακά. Τα κοιτάσματα σουλφιδίου έχουν μεγάλη βιομηχανική σημασία για το σελήνιο. Η περιεκτικότητα σε σελήνιο στα σουλφίδια κυμαίνεται από 7 έως 110 g/t. Η συγκέντρωση του σεληνίου στο θαλασσινό νερό είναι 4·10?4 mg/l.
Το σελήνιο είναι ανάλογο του θείου και εμφανίζει καταστάσεις οξείδωσης;2 (H 2 Se), +4 (SeO 2) και +6 (H 2 SeO 4). Ωστόσο, σε αντίθεση με το θείο, οι ενώσεις του σεληνίου σε κατάσταση οξείδωσης +6 είναι οι ισχυρότεροι οξειδωτικοί παράγοντες και οι ενώσεις σεληνίου (-2) είναι πολύ ισχυρότεροι αναγωγικοί παράγοντες από τις αντίστοιχες ενώσεις θείου.
Η απλή ουσία σελήνιο είναι πολύ λιγότερο χημικά δραστική από το θείο. Έτσι, σε αντίθεση με το θείο, το σελήνιο δεν είναι ικανό να καεί στον αέρα από μόνο του. Το σελήνιο μπορεί να οξειδωθεί μόνο με πρόσθετη θέρμανση, κατά την οποία καίγεται αργά με μπλε φλόγα, μετατρέποντας σε διοξείδιο SeO 2. Το σελήνιο αντιδρά (πολύ βίαια) με αλκαλικά μέταλλα μόνο όταν λιώσει.
Σε αντίθεση με το SO 2, το SeO 2 δεν είναι αέριο, αλλά κρυσταλλική ουσία, εξαιρετικά διαλυτή στο νερό. Η απόκτηση σεληνικού οξέος (SeO 2 + H 2 O > H 2 SeO 3) δεν είναι πιο δύσκολη από το θειικό οξύ. Και δρώντας σε αυτό με έναν ισχυρό οξειδωτικό παράγοντα (για παράδειγμα, HClO 3), παίρνουν σεληνικό οξύ H 2 SeO 4, σχεδόν τόσο ισχυρό όσο το θειικό οξύ.
Αποτελεί μέρος των ενεργών κέντρων ορισμένων πρωτεϊνών με τη μορφή του αμινοξέος σεληνοκυστεΐνη. Ιχνοστοιχείο, αλλά οι περισσότερες ενώσεις είναι αρκετά τοξικές (υδροσεληνίδιο, σεληνικό και σεληνικό οξύ) ακόμη και σε μέτριες συγκεντρώσεις.
Ένας από τους σημαντικότερους τομείς της τεχνολογίας, παραγωγής και κατανάλωσης του είναι οι ημιαγωγικές ιδιότητες τόσο του ίδιου του σεληνίου όσο και των πολυάριθμων ενώσεων του (σεληνίδια), των κραμάτων τους με άλλα στοιχεία στα οποία το σελήνιο άρχισε να παίζει βασικό ρόλο. Αυτός ο ρόλος του σεληνίου αυξάνεται συνεχώς, η ζήτηση και οι τιμές αυξάνονται (εξ ου και η έλλειψη αυτού του στοιχείου).
Στη σύγχρονη τεχνολογία ημιαγωγών, χρησιμοποιούνται σεληνίδια πολλών στοιχείων, για παράδειγμα, σεληνίδια κασσίτερου, μολύβδου, βισμούθιου, αντιμονίου και λανθανιδών. Οι φωτοηλεκτρικές και θερμοηλεκτρικές ιδιότητες τόσο του ίδιου του σεληνίου όσο και των σεληνιδίων είναι ιδιαίτερα σημαντικές.
Το σταθερό ισότοπο σελήνιο-74 κατέστησε δυνατή τη δημιουργία ενός λέιζερ πλάσματος με κολοσσιαία ενίσχυση στην υπεριώδη περιοχή (περίπου ένα δισεκατομμύριο φορές).
Το ραδιενεργό ισότοπο σελήνιο-75 χρησιμοποιείται ως ισχυρή πηγή ακτινοβολίας γάμμα για την ανίχνευση ελαττωμάτων.
Το σεληνιούχο κάλιο μαζί με το πεντοξείδιο του βαναδίου χρησιμοποιείται στη θερμοχημική παραγωγή υδρογόνου και οξυγόνου από το νερό (κύκλος σεληνίου, Lawrence Livermore National Laboratory, Livermore, ΗΠΑ).
Οι ημιαγώγιμες ιδιότητες του σεληνίου στην καθαρή του μορφή χρησιμοποιήθηκαν ευρέως στα μέσα του 20ου αιώνα για την κατασκευή ανορθωτών, ειδικά σε στρατιωτικό εξοπλισμό για τους εξής λόγους: σε αντίθεση με το γερμάνιο και το πυρίτιο, το σελήνιο δεν είναι ευαίσθητο στην ακτινοβολία και, επιπλέον, Η δίοδος ανορθωτή σεληνίου έχει τη μοναδική ιδιότητα να αυτοθεραπεύεται σε περίπτωση βλάβης: η θέση βλάβης εξατμίζεται και δεν οδηγεί σε βραχυκύκλωμα, το επιτρεπόμενο ρεύμα διόδου μειώνεται ελαφρώς, αλλά το προϊόν παραμένει λειτουργικό. Τα μειονεκτήματα των ανορθωτών σεληνίου περιλαμβάνουν τις σημαντικές διαστάσεις τους.
Οι διααργονοειδείς υδροξυ ενώσεις του θείου είναι πιο σταθερές από τις αντίστοιχες ενώσεις χλωρίου και οι ενώσεις του φωσφόρου είναι ακόμη πιο σταθερές. Το υπερχλωρικό οξύ και τα υπερχλωρικά είναι ισχυρά οξειδωτικά μέσα, ενώ το θειικό οξύ και τα θειικά είναι αδύναμα οξειδωτικά μέσα και το φωσφορικό οξύ και τα φωσφορικά είναι ακόμη πιο αδύναμα. Αυτή η διαφορά στις ιδιότητες αντιστοιχεί στις τιμές ηλεκτραρνητικότητας Χ= 3 για το Cl, 2,5 για το S, 2,1 για το P και Δx(σε σχέση με το οξυγόνο) είναι ίσο με 0,5 για το Cl, 1,0 για το S, 1,4 για το P. Οι χαρακτηριστικές τιμές των θερμοτήτων αντίδρασης που δίνονται παρακάτω αντικατοπτρίζουν μια αύξηση στις τιμές Δx:
HCl (g.) + 2O 2 (g.) → HClO 4 (l.) + 8 kJ mol -1
H 2 S (g.) + 2O 2 (g.) → H 2 SO 4 (l.) + 790 kJ mol -1
H 3 R (g.) + 2O 2 (g.) → H 3 PO 4 (l.) + 1250 kJ mol -1
Οι σταθερές ενώσεις θείου, σεληνίου και τελλουρίου αντιστοιχούν σε διάφορες καταστάσεις οξείδωσης από -2 έως +6, όπως φαίνεται στο συνημμένο διάγραμμα:
6 SO 3 , H 2 SO 4 , SF 6 H 2 SeO 4 , SeF 6 TeO 3 , Te(OH) 6 , TeF 6
4 SO 2, H 2 SO 3 SeO 2, H 2 SeO 3 TeO 2
0 S 8 , S 2 Se Te
2 H 2 S, S 2- H 2 Se H 2 Te
Οξείδια του θείου
Κανονικό σθένος οξείδιο του θείου(μονοξείδιο) Το SO είναι σημαντικά λιγότερο σταθερό από τα δια-αργονοειδή οξείδια SO 2 και SO 3. Οι θερμότητες σχηματισμού τους έχουν τις ακόλουθες τιμές:
1/8S 8 (k.) + 1/2O 2 (g.) → SO (g.) - 7 kJ mol -1
1/8S 8 (k.) + O 2 (g.) → SO 2 (g.) + 297 kJ mol -1
1/8S 8 (k.) + 3/2O 2 (g.) → SO 3 (g.) + 396 kJ mol -1
Από τις δύο πρώτες εξισώσεις προκύπτει ότι η αποσύνθεση του οξειδίου του θείου σε διοξείδιο του θείου και θείο συνοδεύεται από την απελευθέρωση μεγάλης ποσότητας θερμότητας
2SO (g.) → 1/8S 8 (k.) + SO 2 (g.) + 311 kJ mol -1
Επομένως, δεν προκαλεί έκπληξη το γεγονός ότι το οξείδιο του θείου δεν είναι γνωστό ότι είναι μια σταθερή ένωση, αλλά υπάρχει μόνο ως εξαιρετικά δραστικά μόρια σε μια πολύ σπάνια αέρια κατάσταση ή σε παγωμένες μήτρες. Αυτό το οξείδιο έχει τη δομή
με δύο ηλεκτρόνια που έχουν παράλληλα σπιν, και μοιάζει με τα μόρια O 2 και S 2.
Διοξείδιο του θείουΤο SO 2 σχηματίζεται κατά την καύση θείου ή σουλφιδίων, όπως ο πυρίτης (FeS 2)
S + O 2 → SO 2
FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
Είναι ένα άχρωμο αέριο με χαρακτηριστική πικάντικη οσμή. Τα σημεία τήξης και βρασμού του διοξειδίου του θείου είναι -75 και -10 °C, αντίστοιχα.
Στο εργαστήριο, το διοξείδιο του θείου παράγεται συνήθως από τη δράση ενός ισχυρού οξέος σε στερεό θειώδες οξύ νατρίου
H 2 SO 4 + NaHSO 3 → NaHSO 4 + H 2 O + SO 2
Μπορεί να καθαριστεί και να στεγνώσει με φυσαλίδες μέσω πυκνού θειικού οξέος. Το διοξείδιο του θείου έχει την ακόλουθη ηλεκτρονική δομή:
Αυτή η δομή χρησιμοποιεί ένα 3 ρε-τροχιακό καθώς και 3 μικρό- τροχιακό και τρία 3 Π-τροχιακά. Το πειραματικά προσδιορισμένο μήκος δεσμού θείου-οξυγόνου είναι 143 pm. αυτή είναι κάπως μικρότερη από την τιμή των 149 μ.μ. που θα αναμενόταν για ένα διπλό ομόλογο. Η γωνία O-S-O είναι 119,5°.
Μεγάλες ποσότητες διοξειδίου του θείου χρησιμοποιούνται για την παραγωγή θειικού οξέος, θειικού οξέος και θειωδών αλάτων. Το SO 2 σκοτώνει μύκητες και βακτήρια και χρησιμοποιείται στην κονσερβοποίηση και αποξήρανση δαμάσκηνων, βερίκοκων και άλλων φρούτων. Ένα διάλυμα όξινου θειώδους ασβεστίου Ca(HSO 3) 2, που λαμβάνεται με την αντίδραση διοξειδίου του θείου με υδροξείδιο του ασβεστίου, χρησιμοποιείται για την παραγωγή χαρτοπολτού από ξύλο. Διαλύει τη λιγνίνη, την ουσία που συγκρατεί τις ίνες κυτταρίνης μαζί, και απελευθερώνει αυτές τις ίνες, οι οποίες στη συνέχεια μετατρέπονται σε χαρτί.
Τριοξείδιο (τριοξείδιο)Το θείο SO 3 σχηματίζεται σε πολύ μικρές ποσότητες όταν το θείο καίγεται στον αέρα. Συνήθως παράγεται με οξείδωση διοξειδίου του θείου με αέρα παρουσία καταλύτη. Η αντίδραση του σχηματισμού αυτής της ένωσης από απλές ουσίες είναι εξώθερμη, αλλά λιγότερο εξώθερμη (ανά άτομο οξυγόνου) από την αντίδραση σχηματισμού διοξειδίου του θείου. Χαρακτηριστικό ισορροπίας
SO 2 (g.) + 1/2O 2 (g.) → SO 3 (g.)
είναι ότι μπορεί να επιτευχθεί ικανοποιητική απόδοση SO 3 σε χαμηλές θερμοκρασίες. η αντίδραση προχωρά σχεδόν πλήρως. Ωστόσο, σε χαμηλές θερμοκρασίες ο ρυθμός αντίδρασης είναι τόσο χαμηλός που ο άμεσος συνδυασμός των αντιδρώντων δεν μπορεί να χρησιμοποιηθεί ως βάση για μια βιομηχανική διαδικασία. Σε υψηλές θερμοκρασίες, όταν επιτυγχάνεται ικανοποιητικός ρυθμός αντίδρασης, η απόδοση είναι χαμηλή λόγω της δυσμενούς θέσης ισορροπίας.
Η λύση σε αυτό το πρόβλημα ήταν η ανακάλυψη των κατάλληλων καταλυτών (πλατίνα, πεντοξείδιο του βαναδίου), οι οποίοι επιταχύνουν την αντίδραση χωρίς να επηρεάζουν την ισορροπία της. Η καταλυτική αντίδραση δεν συμβαίνει σε ένα μείγμα αερίων, αλλά στην επιφάνεια του καταλύτη όταν τα μόρια έρχονται σε επαφή με αυτόν. Στην πράξη, το διοξείδιο του θείου, που λαμβάνεται με καύση θείου ή πυρίτη, αναμιγνύεται με αέρα και περνά πάνω από έναν καταλύτη σε θερμοκρασία 400-450°C. Υπό αυτές τις συνθήκες, περίπου το 99% του διοξειδίου του θείου μετατρέπεται σε τριοξείδιο του θείου. Αυτή η μέθοδος χρησιμοποιείται κυρίως στην παραγωγή θειικού οξέος.
Το τριοξείδιο του θείου είναι ένα εξαιρετικά διαβρωτικό αέριο. αναμιγνύεται έντονα με το νερό για να δώσει θειικό οξύ
SO 3 (g.) + H 2 O (l.) → H 2 SO 4 (l.) + 130 kJ mol -1
Ρύζι. 8.3.Τριοξείδιο του θείου και μερικά οξέα θείου οξυγόνου.
Το τριοξείδιο του θείου διαλύεται εύκολα σε θειικό οξύ για να σχηματιστεί έλαιο, ή ατμίζον θειικό οξύπου αποτελείται κυρίως από δισουλφουρικό οξύ H 2 S 2 O 7 (ονομάζεται επίσης πυροθειικό οξύ)
SO 3 + H 2 SO 4 ⇔ H 2 S 2 O 7
Στους 44,5°C, το τριοξείδιο του θείου συμπυκνώνεται σε ένα άχρωμο υγρό, το οποίο στερεοποιείται στους 16,8°C για να σχηματίσει διαφανείς κρυστάλλους. Αυτή η ουσία είναι πολυμορφική και οι κρύσταλλοι που σχηματίζονται στους 16,8°C είναι μια ασταθής μορφή (α-μορφή). Η σταθερή μορφή είναι μεταξένιοι κρύσταλλοι, παρόμοιοι με τον αμίαντο, που σχηματίζονται όταν οι κρύσταλλοι άλφα ή υγρό διατηρούνται για μικρό χρονικό διάστημα παρουσία ιχνών υγρασίας (Εικ. 8.3). Υπάρχουν επίσης αρκετές άλλες μορφές αυτής της ουσίας, αλλά είναι δύσκολο να μελετηθούν λόγω της εξαιρετικά αργής μετατροπής μιας μορφής σε άλλη. Σε θερμοκρασίες άνω των 50°C, οι κρύσταλλοι που μοιάζουν με αμίαντο εξατμίζονται αργά, σχηματίζοντας ατμό SO 3.
Τα μόρια τριοξειδίου του θείου στην αέρια φάση, σε υγρούς και άλφα κρυστάλλους έχουν ηλεκτρονική δομή
Το μόριο έχει επίπεδη δομή με το ίδιο μήκος δεσμού (143 pm) όπως στο μόριο του διοξειδίου του θείου.
Οι ιδιότητες του τριοξειδίου του θείου μπορούν να εξηγηθούν σε μεγάλο βαθμό από τη χαμηλότερη σταθερότητα του διπλού δεσμού θείου-οξυγόνου σε σύγκριση με δύο απλούς δεσμούς μεταξύ τους. Έτσι, ως αποτέλεσμα της αντίδρασης με το νερό, ένας διπλός δεσμός σε τριοξείδιο του θείου αντικαθίσταται από δύο απλούς δεσμούς στο προκύπτον θειικό οξύ
Η αυξημένη σταθερότητα του προϊόντος αποδεικνύεται από τη μεγάλη ποσότητα θερμότητας που απελευθερώνεται κατά την αντίδραση.
Θειώδες οξύ
Ένα διάλυμα θειικού οξέος H 2 SO 3 παρασκευάζεται με διάλυση διοξειδίου του θείου σε νερό. Τόσο το θειικό οξύ όσο και τα άλατά του, τα θειώδη, είναι ισχυροί αναγωγικοί παράγοντες. Σχηματίζουν θειικό οξύ H 2 SO 4 και θειικά άλατα όταν οξειδώνονται με οξυγόνο, αλογόνα, υπεροξείδιο του υδρογόνου και παρόμοια οξειδωτικά μέσα.
Το θειικό οξύ έχει τη δομή
Θειικό οξύ και θειικά άλατα
Το θειικό οξύ H 2 SO 4 είναι ένα από τα πιο σημαντικά χημικά προϊόντα που χρησιμοποιούνται στη χημική βιομηχανία και σε συναφείς βιομηχανίες. Αυτό είναι ένα βαρύ ελαιώδες υγρό (πυκνότητα 1,838 g cm -3), ελαφρώς καπνιστό στον αέρα λόγω της απελευθέρωσης ιχνών τριοξειδίου του θείου, τα οποία στη συνέχεια συνδυάζονται με υδρατμούς για να σχηματίσουν σταγονίδια θειικού οξέος. Το καθαρό θειικό οξύ, όταν θερμαίνεται, παράγει ατμό πλούσιο σε τριοξείδιο του θείου, και στη συνέχεια βράζει στους 338 ° C, διατηρώντας μια σταθερή σύνθεση (98% H 2 SO 4 και 2 % H 2 O). Αυτό είναι ένα συνηθισμένο βιομηχανικό «συμπυκνωμένο θειικό οξύ».
Το πυκνό θειικό οξύ είναι πολύ διαβρωτικό. Συνδέεται άπληστα με το νερό. η ανάμιξη με νερό συνοδεύεται από την απελευθέρωση μεγάλης ποσότητας θερμότητας ως αποτέλεσμα του σχηματισμού ιόντων υδρονίου
H 2 SO 4 + 2H 2 O → 2H 3 O + + SO 4 2-
Για αραίωση πυκνού θειικού οξέος θα πρέπει να χύνεται σε νερό με ένα λεπτό ρεύμαενώ ανακατεύετε το διάλυμα. νερό δεν μπορεί να προστεθεί σε οξύ, καθώς αυτό θα προκαλέσει βρασμό και δυνατό πιτσίλισμα του οξέος. Ένα αραιωμένο οξύ καταλαμβάνει μικρότερο όγκο από τα συστατικά του και το αποτέλεσμα της μείωσης του όγκου είναι μέγιστο στην αναλογία H 2 SO 4: H 2 O = 1: 2 [(H 3 O +) 2 (SO 4) 2-].
Χημικές ιδιότητες και χρήσεις του θειικού οξέος
Η χρήση του θειικού οξέος καθορίζεται από τις χημικές του ιδιότητες - χρησιμοποιείται ως οξύ, ως αφυδατωτικός παράγοντας και ως οξειδωτικός παράγοντας.
Το θειικό οξύ έχει υψηλό σημείο βρασμού (330°C), γεγονός που καθιστά δυνατή τη χρήση του για την επεξεργασία αλάτων πιο πτητικών οξέων προκειμένου να ληφθούν αυτά τα οξέα. Το νιτρικό οξύ, για παράδειγμα, μπορεί να παρασκευαστεί με θέρμανση νιτρικού νατρίου με θειικό οξύ
NaNO 3 + H 2 SO 4 → NaHSO 4 + HNO 3
Το νιτρικό οξύ αποστάζεται στους 86°C. Το θειικό οξύ χρησιμοποιείται επίσης για την παραγωγή διαλυτών φωσφορικών λιπασμάτων, θειικού αμμωνίου που χρησιμοποιείται ως λίπασμα, άλλων θειικών αλάτων και πολλών χημικών και φαρμακευτικών προϊόντων. Ο χάλυβας συνήθως καθαρίζεται από τη σκουριά με εμβάπτιση σε ένα λουτρό θειικού οξέος («τουρσί») πριν επικαλυφθεί με ψευδάργυρο, κασσίτερο ή σμάλτο. Το θειικό οξύ χρησιμεύει ως ηλεκτρολύτης στις συμβατικές μπαταρίες μολύβδου.
Το θειικό οξύ έχει τόσο ισχυρή ικανότητα να απορροφά νερό που μπορεί να χρησιμοποιηθεί ως αποτελεσματικός αφυδατωτής. Τα αέρια που δεν αντιδρούν με το θειικό οξύ μπορούν να στεγνώσουν περνώντας από αυτό. Η ικανότητα αφυδάτωσης του πυκνού θειικού οξέος είναι τόσο μεγάλη που οργανικές ενώσεις όπως η ζάχαρη, υπό τη δράση της, χάνουν υδρογόνο και οξυγόνο με τη μορφή νερού
$C_(12)H_(22)O_(11) \δεξιό βέλος 12C + 11H_(2)O$
Ζάχαρη (σακχαρόζη) H 2 SO 4
Πολλά εκρηκτικά, όπως η νιτρογλυκερίνη, παράγονται από την αντίδραση μεταξύ οργανικών ενώσεων και νιτρικού οξέος, με αποτέλεσμα το σχηματισμό εκρηκτικού και νερού, π.χ.
C 3 H 5 (OH) 3 + 3HNO 3 → C 3 H 5 (NO 3) 3 + 3H 2 O
Γλυκερίνη H 2 SO 4 Νιτρογλυκερίνη
Για να προχωρήσουν αυτές οι αναστρέψιμες αντιδράσεις από αριστερά προς τα δεξιά, το νιτρικό οξύ αναμιγνύεται με θειικό οξύ, το οποίο, λόγω της αφυδάτωσης του, προάγει τον σχηματισμό προϊόντων αντίδρασης. (Δύο άλλα παραδείγματα δίνονται στην Ενότητα 7.7.)
Το θερμό συμπυκνωμένο θειικό οξύ είναι ένας ισχυρός οξειδωτικός παράγοντας. το προϊόν της αναγωγής του είναι το διοξείδιο του θείου. Το θειικό οξύ διαλύει τον χαλκό και μπορεί ακόμη και να οξειδώσει τον άνθρακα
Cu + 2H 2 SO 4 → CuSO 4 + 2H 2 O + SO 2
C + 2H 2 SO 4 → CO 2 + 2H 2 O + 2SO 2
Η διάλυση του χαλκού σε θερμό πυκνό θειικό οξύ απεικονίζει τη γενική αντίδραση - διάλυση ενός ανενεργού μετάλλου σε ένα οξύ με την ταυτόχρονη δράση ενός οξειδωτικού παράγοντα. Τα ενεργά μέταλλα οξειδώνονται σε κατιόντα με τη δράση ενός ιόντος υδρογόνου, το οποίο στη συνέχεια ανάγεται σε στοιχειακό υδρογόνο, για παράδειγμα
Zn + 2Н + → Zn 2+ + Н 2 (g.)
Παρόμοια αντίδραση δεν συμβαίνει με τον χαλκό. Ωστόσο, ο χαλκός μπορεί να οξειδωθεί σε ιόν Cu 2+ με τη δράση ενός ισχυρού οξειδωτικού παράγοντα, όπως το χλώριο ή το νιτρικό οξύ, ή, όπως φαίνεται παραπάνω, με θερμό πυκνό θειικό οξύ.
Θειικά
Το θειικό οξύ συνδυάζεται με βάσεις για να σχηματίσει θειικά μεσαία άλατα, όπως K 2 SO 4 (θειικό κάλιο) και θειικά οξέα (μερικές φορές ονομάζονται διθειικά), όπως θειικό όξινο κάλιο KHSO 4.
Ελαφρώς διαλυτά θειικά άλατα βρίσκονται με τη μορφή ορυκτών, τα οποία περιλαμβάνουν CaSO 4 2H 2 O (γύψος), SrSO 4, BaSO 4 (βαρίτης) και PbSO 4. Το λιγότερο διαλυτό από όλα τα θειικά είναι το θειικό βάριο. Επομένως, ο σχηματισμός του ως λευκό ίζημα χρησιμεύει ως ποιοτική αντίδραση στο θειικό ιόν.
Τα πιο κοινά διαλυτά θειικά άλατα περιλαμβάνουν: Na 2 SO 4 10H 2 O, (NH 4) 2 SO 4, MgSO 4 7H 2 O (πικρό αλάτι), CuSO 4 5H 2 O (θειικός χαλκός), FeSO 4 7H 2 O, ( NH 4) 2 Fe(SO 4) 2 6H 2 O (ένα καλά κρυσταλλοποιούμενο και εύκολα καθαριζόμενο άλας που χρησιμοποιείται στην αναλυτική χημεία για την παρασκευή τυπικών διαλυμάτων δισθενούς σιδήρου), ZnSO 4 7H 2 O, KAl(SO 4) 2 12H 2 O (στυπτηρία), (NH 4)Al(SO 4) 2 12H 2 O (αλουμίνιο-αμμώνιο στυπτηρία) και KCr(SO 4) 2 12H 2 O (στυπτηρία χρωμίου).
Θειο- ή σουλφονικά οξέα
Το θειοθειικό νάτριο Na 2 S 2 O 3 ·5H 2 O (λανθασμένα ονομάζεται «υποθειώδες νάτριο») είναι μια ουσία που χρησιμοποιείται στη φωτογραφία. Λαμβάνεται με βρασμό διαλύματος θειώδους νατρίου με καθαρό θείο
SO 3 2- + S → S 2 O 3 2-
Διθειώδες ιόν Θειοθειικό ιόν
Το θειοθειικό οξύ H 2 S 2 O 3 είναι ασταθές. Όταν το θειοθειικό υποβάλλεται σε επεξεργασία με οξύ, σχηματίζεται διοξείδιο του θείου και θείο.
Η δομή του θειοθειικού ιόντος S 2 O 3 2- είναι ενδιαφέρουσα από το ότι τα δύο άτομα θείου δεν είναι ισοδύναμα. Αυτό το ιόν είναι ένα θειικό ιόν SO 4 2-, στο οποίο ένα από τα άτομα οξυγόνου αντικαθίσταται από ένα άτομο θείου (Εικ. 8.4). Στο κεντρικό άτομο θείου μπορεί να αποδοθεί μια κατάσταση οξείδωσης +6, και στο συνδεδεμένο άτομο θείου μπορεί να αποδοθεί μια κατάσταση οξείδωσης -2.
Το θειοθειικό ιόν οξειδώνεται εύκολα, ειδικά από το ιώδιο, σε τετραθειονικό ιόν S 4 O 6 2-
2S 2 O 3 2- → S 4 O 6 2- +2 μι
2S 2 O 3 2- +I 2 → S 4 O 6 2- + 2I -
Αυτή η αντίδραση μεταξύ θειοθειικού ιόντος και ιωδίου χρησιμοποιείται ευρέως στην ποσοτική ανάλυση ουσιών με οξειδωτικές ή αναγωγικές ιδιότητες.
Ρύζι. 8.4.Θειοθειικά και τετραθειονικά ιόντα.
Σελήνιο και τελλούριο
Οι διααργονοειδείς ενώσεις σεληνίου μοιάζουν πολύ με τις αντίστοιχες ενώσεις θείου. Τα σεληνικά, τα άλατα του σεληνικού οξέος H 2 SeO 4 είναι πολύ παρόμοια με τα θειικά. Το τελλουρικό οξύ έχει τον τύπο Te(OH) 6 και το μεγάλο κεντρικό άτομο έχει αριθμό συντονισμού όχι 4, αλλά 6, ακριβώς όπως το άτομο ιωδίου στο μόριο H 5 IO 6.