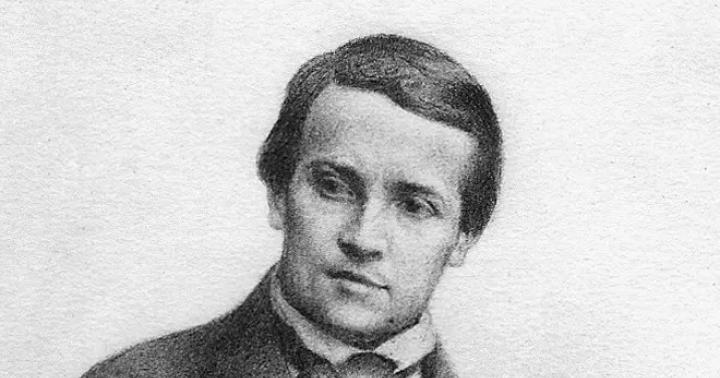Hipermarket de cunoștințe >>Chimie >>Chimie clasa a X-a >> Chimie: alchene
Nesaturatele includ hidrocarburile care conțin legături multiple între atomi de carbon în moleculele lor. Alchenele, alchinele și alcadienele (poliene) sunt nesaturate. Hidrocarburile ciclice care conțin o dublă legătură în ciclu (cicloalchene), precum și cicloalcanii cu un număr mic de atomi de carbon în ciclu (trei sau patru atomi) au și ele un caracter nesaturat. Proprietatea „nesaturației” este asociată cu capacitatea acestor substanțe de a intra în reacții de adiție, în principal hidrogen, cu formarea de hidrocarburi saturate sau saturate - alcani.
Structura
Alchenele sunt aciclice, conținând în moleculă, pe lângă legăturile simple, o legătură dublă între atomi de carbon și corespunzătoare formulei generale C n H 2n.
Alchenele și-au primit al doilea nume - „olefine” prin analogie cu acizii grași nesaturați (oleic, linoleic), ale căror rămășițe fac parte din grăsimi lichide - uleiuri (din engleză ulei - ulei).
Atomii de carbon care au o legătură dublă între ei, după cum știți, sunt într-o stare de hibridizare sp 2. Aceasta înseamnă că un orbital s și doi p sunt implicați în hibridizare, iar un orbital p rămâne nehibridat. Suprapunerea orbitalilor hibrizi duce la formarea unei legături a și, datorită orbitalilor nehibridați ai atomilor de carbon vecini ai moleculei de etilenă, se formează un al doilea, P-conexiune. Astfel, o legătură dublă constă dintr-o legătură Þ și o legătură p.
Orbitalii hibrizi ai atomilor care formează o legătură dublă sunt în același plan, iar orbitalii care formează o legătură n sunt situați perpendicular pe planul moleculei (vezi Fig. 5).
Legătura dublă (0,132 nm) este mai scurtă decât legătura simplă, iar energia sa este mai mare, adică este mai puternică. Cu toate acestea, prezența unei legături 7g mobile, ușor polarizabile, duce la faptul că alchenele sunt mai active din punct de vedere chimic decât alcanii și sunt capabile să sufere reacții de adiție.
Serii omoloage de etenă
Alchenele cu catenă dreaptă formează seria omoloagă de etenă (etilenă).
C2H4 - etenă, C3H6 - propenă, C4H8 - butenă, C5H10 - pentenă, C6H12 - hexenă etc.
Izomerie și nomenclatură
Alchenele, ca și alcanii, se caracterizează prin izomerie structurală. Izomerii structurali, după cum vă amintiți, diferă unul de celălalt în structura scheletului de carbon. Cea mai simplă alchenă, caracterizată prin izomeri structurali, este butena.
CH3-CH2-CH=CH2CH3-C=CH2
l
CH3
buten-1 metilpropenă
Un tip special de izomerie structurală este izomeria poziției dublei legături:
CH3-CH2-CH=CH2CH3-CH=CH-CH3
buten-1 buten-2
Rotația aproape liberă a atomilor de carbon este posibilă în jurul unei singure legături carbon-carbon, astfel încât moleculele de alcani pot lua o mare varietate de forme. Rotația în jurul legăturii duble este imposibilă, ceea ce duce la apariția unui alt tip de izomerie în alchene - geometrice sau izomerie cis-trans.
Izomerii cis diferă de izomerii toracelui în aranjarea spațială a fragmentelor moleculare (în acest caz, grupări metil) în raport cu planul P-conexiuni, și deci proprietăți.
Alchenele sunt izomeri la cicloalcani (izomerie interclasă), de exemplu:
CH2 = CH-CH2-CH2-CH2-CH3
hexen-1 ciclohexan
Nomenclatură alchene, dezvoltat de IUPAC, este similar cu nomenclatura alcanilor.
1. Selectarea circuitului principal
Formarea numelui unei hidrocarburi începe cu definirea lanțului principal - cel mai lung lanț de atomi de carbon din moleculă. În cazul alchenelor, lanțul principal trebuie să conțină o legătură dublă.
2. Numerotarea atomilor din lanțul principal
Numerotarea atomilor lanțului principal începe de la capătul de care este cea mai apropiată legătură dublă. De exemplu, numele corect al conexiunii este
dn3-dn-dn2-dn=dn-dn3 dn3
5-metilhexen-2, nu 2-metilhexen-4, așa cum s-ar putea aștepta.
Dacă poziția dublei legături nu poate determina începutul numerotării atomilor din lanț, atunci aceasta este determinată de poziția substituenților în același mod ca și pentru hidrocarburile saturate.
CH3-CH2-CH=CH-CH-CH3
l
CH3
2-metilhexen-3
3. Formarea numelui
Denumirile alchenelor sunt formate în același mod ca și numele alcanilor. La sfârșitul numelui, indicați numărul atomului de carbon de la care începe legătura dublă și sufixul care indică faptul că compusul aparține clasei alchenelor, -ene.
Chitanță
1. Cracarea produselor petroliere. În procesul de cracare termică a hidrocarburilor saturate, odată cu formarea de alcani, are loc formarea de alchene.
2. Dehidrogenarea hidrocarburilor saturate. Când alcanii sunt trecuți peste un catalizator la temperaturi ridicate (400-600 °C), o moleculă de hidrogen este eliminată și se formează o alchenă: 
3. Deshidratarea alcoolilor (eliminarea apei). Efectul agenților de îndepărtare a apei (H2804, Al203) asupra alcoolilor monohidroxilici la temperaturi ridicate duce la eliminarea unei molecule de apă și formarea unei duble legături:
Această reacție se numește deshidratare intramoleculară (spre deosebire de deshidratarea intermoleculară, care duce la formarea de eteri și va fi studiată în § 16 „Alcooli”).
4. Dehidrohalogenarea (eliminarea halogenurilor de hidrogen).
Când un haloalcan reacționează cu un alcali într-o soluție de alcool, se formează o legătură dublă ca urmare a eliminării unei molecule de halogenură de hidrogen.
Rețineți că această reacție produce predominant buten-2, mai degrabă decât buten-1, ceea ce corespunde Regula lui Zaitsev:
Când o halogenură de hidrogen este eliminată din haloalcanii secundari și terțiari, un atom de hidrogen este eliminat din atomul de carbon cel mai puțin hidrogenat.
5. Dehalogenarea. Când zincul acționează asupra unui derivat dibrom al unui alcan, atomii de halogen situati la atomii de carbon vecini sunt eliminați și se formează o legătură dublă: 
Proprietăți fizice
Primii trei reprezentanți ai seriei omoloage de alchene sunt gazele, substanțele din compoziția C5H10-C16H32 sunt lichide, iar alchenele superioare sunt solide.
Punctele de fierbere și de topire cresc în mod natural odată cu creșterea greutății moleculare a compușilor.
Proprietăți chimice
Reacții de adaos
Să ne amintim că o trăsătură distinctivă a reprezentanților hidrocarburilor nesaturate - alchene este capacitatea de a intra în reacții de adiție. Cele mai multe dintre aceste reacții au loc prin mecanismul de adiție electrofilă.
1. Hidrogenarea alchenelor. Alchenele sunt capabile să adauge hidrogen în prezența catalizatorilor de hidrogenare - metale - platină, paladiu, nichel:
CH3-CH2-CH=CH2 + H2 -> CH3-CH2-CH2-CH3
Această reacție are loc atât la presiune atmosferică, cât și la presiune ridicată și nu necesită temperatură ridicată, deoarece este exotermă. Când temperatura crește, aceiași catalizatori pot provoca o reacție inversă - dehidrogenare.
2. Halogenare (adăugarea de halogeni). Interacțiunea unei alchene cu apa de brom sau o soluție de brom într-un solvent organic (CCl4) duce la decolorarea rapidă a acestor soluții ca urmare a adăugării unei molecule de halogen la alchenă și a formării dihaloalcanilor.
Markovnikov Vladimir Vasilievici
(1837-1904)
chimist organic rus. A formulat (1869) reguli privind direcția de substituție, eliminare, adăugare la o legătură dublă și reacții de izomerizare în funcție de structura chimică. A studiat (din 1880) compoziția petrolului și a pus bazele petrochimiei ca știință independentă. A descoperit (1883) o nouă clasă de substanțe organice - ciclo-parafinele (naftene).
3. Hidrohalogenare (adaos de halogenură de hidrogen).
Reacția de adiție cu halogenură de hidrogen va fi discutată mai detaliat mai jos. Această reacție se supune regulii lui Markovnikov:
Când o halogenură de hidrogen se leagă de o alchenă, hidrogenul se atașează de atomul de carbon mai hidrogenat, adică atomul la care există mai mulți atomi de hidrogen, iar halogenul de cel mai puțin hidrogenat.
4. Hidratarea (adăugarea de apă). Hidratarea alchenelor duce la formarea de alcooli. De exemplu, adăugarea de apă la etenă este baza uneia dintre metodele industriale de producere a alcoolului etilic:
CH2=CH2 + H2O -> CH3-CH2OH
eten etanol
Rețineți că un alcool primar (cu o grupare hidroxi pe carbonul primar) se formează numai atunci când etena este hidratată. Când propena sau alte alchene sunt hidratate, se formează alcooli secundari. 
Această reacție se desfășoară, de asemenea, în conformitate cu regula lui Markovnikov - un cation de hidrogen se atașează la un atom de carbon mai hidrogenat, iar o grupare hidroxi se atașează la unul mai puțin hidrogenat.
5. Polimerizare. Un caz special de adiție este reacția de polimerizare a alchenelor:
Această reacție de adiție are loc printr-un mecanism de radicali liberi.
Reacții de oxidare
Ca orice compuși organici, alchenele ard în oxigen pentru a forma CO2 și H20.
Spre deosebire de alcani, care sunt rezistenți la oxidare în soluții, alchenele sunt ușor oxidate prin acțiunea soluțiilor apoase de permanganat de potasiu. În soluții neutre sau ușor alcaline, alchenele sunt oxidate la dioli (alcooli dihidroxilici), iar la acei atomi între care a existat o dublă legătură înainte de oxidare se adaugă grupări hidroxil.
După cum știți deja, hidrocarburile nesaturate - alchene sunt capabile să intre în reacții de adiție. Cele mai multe dintre aceste reacții au loc prin mecanismul de adiție electrofilă.
Conexiune electrofilă
Reacțiile electrofile sunt reacții care apar sub influența electrofililor - particule care au o lipsă de densitate electronică, de exemplu, un orbital neumplut. Cea mai simplă particulă electrofilă este cationul hidrogen. Se știe că atomul de hidrogen are un electron în al treilea orbital. Un cation de hidrogen se formează atunci când un atom pierde acest electron, astfel că cationul de hidrogen nu are deloc electroni:
Н· - 1е - -> Н +
În acest caz, cationul are o afinitate electronică destul de mare. Combinația acestor factori face ca cationul de hidrogen să fie o particulă electrofilă destul de puternică.
Formarea unui cation de hidrogen este posibilă în timpul disocierii electrolitice a acizilor:
НВr -> Н + + Вr -
Din acest motiv, multe reacții electrofile apar în prezența și participarea acizilor.
Particulele electrofile, așa cum am menționat mai devreme, acționează asupra sistemelor care conțin zone cu densitate electronică crescută. Un exemplu de astfel de sistem este o legătură multiplă (dublă sau triplă) carbon-carbon.
Știți deja că atomii de carbon între care se formează o legătură dublă sunt în stare de hibridizare sp 2. Orbitalii p nehibridați ai atomilor de carbon vecini aflați în același plan se suprapun, formându-se P-legatura, care este mai putin puternica decat legatura Þ si, cel mai important, se polarizeaza usor sub influenta unui camp electric extern. Aceasta înseamnă că atunci când o particulă încărcată pozitiv se apropie, electronii legăturii CS se deplasează spre ea și așa-numita P- complex.
Se dovedește P-complex și la adăugarea unui cation de hidrogen la P- conexiuni. Cationul de hidrogen pare să se lovească de densitatea electronică care iese din planul moleculei P-conectare și se alătură acesteia. ![]()
În etapa următoare, are loc o deplasare completă a perechii de electroni P-legarea la unul dintre atomii de carbon, ceea ce duce la apariția unei perechi de electroni singuratice pe acesta. Orbitul atomului de carbon pe care se află această pereche și orbitalul neocupat al cationului de hidrogen se suprapun, ceea ce duce la formarea unei legături covalente prin mecanismul donor-acceptor. Al doilea atom de carbon are încă un orbital neumplut, adică o sarcină pozitivă.
Particula rezultată se numește carbocation deoarece conține o sarcină pozitivă asupra atomului de carbon. Această particulă se poate combina cu orice anion, o particulă care are o pereche de electroni singuratică, adică un nucleofil.
Să luăm în considerare mecanismul reacției de adiție electrofilă folosind exemplul de bromhidratare (adăugarea de bromură de hidrogen) a etenei:
СН2= СН2 + НВг --> СНВr-СН3
Reacția începe cu formarea unei particule electrofile - un cation de hidrogen, care are loc ca urmare a disocierii unei molecule de bromură de hidrogen.
Atacuri de cationi de hidrogen P- legătură, formare P- un complex care se transformă rapid într-un carbocation: 
Acum să ne uităm la un caz mai complex.
Reacția de adăugare a bromurii de hidrogen la etenă se desfășoară fără ambiguitate, iar interacțiunea bromurii de hidrogen cu propena poate da teoretic doi produși: 1-brompropan și 2-bromopropan. Datele experimentale arată că 2-bromopropanul este produs în principal.
Pentru a explica acest lucru, va trebui să luăm în considerare particula intermediară - carbocationul.
Adăugarea unui cation de hidrogen la propenă poate duce la formarea a doi carbocationi: dacă un cation de hidrogen se unește cu primul atom de carbon, atomul situat la capătul lanțului, atunci al doilea va avea o sarcină pozitivă, adică în centrul moleculei (1); dacă se alătură celui de-al doilea, atunci primul atom va avea o sarcină pozitivă (2). 
Direcția preferențială a reacției va depinde de care carbocation este mai abundent în mediul de reacție, care, la rândul său, este determinat de stabilitatea carbocationului. Experimentul arată formarea predominantă a 2-bromopropanului. Aceasta înseamnă că formarea carbocationului (1) cu sarcină pozitivă pe atomul central are loc într-o măsură mai mare.
Stabilitatea mai mare a acestui carbocation se explică prin faptul că sarcina pozitivă asupra atomului de carbon central este compensată de efectul inductiv pozitiv al două grupări metil, al căror efect total este mai mare decât efectul +/- al unei grupări etil:
Legile reacțiilor de hidrohalogenare a alchenelor au fost studiate de celebrul chimist rus V.V Markovnikov, un student al lui A.M Butlerov, care, după cum am menționat mai sus, a formulat regula care îi poartă numele.
Această regulă a fost stabilită empiric, adică experimental. În prezent, putem oferi o explicație complet convingătoare pentru aceasta.
Interesant este că și alte reacții de adiție electrofile se supun regulii lui Markovnikov, așa că ar fi corect să o formulăm într-o formă mai generală.
În reacțiile de adiție electrofile, un electrofil (o particulă cu un orbital neumplut) se adaugă la un atom de carbon mai hidrogenat, iar un nucleofil (o particulă cu o pereche de electroni singură) se adaugă la unul mai puțin hidrogenat.
Polimerizare
Un caz special de reacție de adiție este reacția de polimerizare a alchenelor și a derivaților acestora. Această reacție are loc prin mecanismul de adăugare a radicalilor liberi:
Polimerizarea se realizează în prezența inițiatorilor - compuși peroxidici, care sunt o sursă de radicali liberi. Compușii peroxidici sunt substanțe ale căror molecule includ grupa -O-O-. Cel mai simplu compus cu peroxid este peroxidul de hidrogen HOOH.
La o temperatură de 100 °C și o presiune de 100 MPa are loc omoliza legăturii instabile oxigen-oxigen și formarea de radicali - inițiatori ai polimerizării. Sub influența radicalilor KO- se inițiază polimerizarea, care se dezvoltă ca o reacție de adiție a radicalilor liberi. Creșterea lanțului se oprește atunci când are loc recombinarea radicalilor în amestecul de reacție - lanțul polimeric și radicalii sau COCH2CH2-.
Folosind reacția de polimerizare prin radicali liberi a substanțelor care conțin o legătură dublă, se obțin un număr mare de compuși cu greutate moleculară mare: 
Utilizarea alchenelor cu diverși substituenți face posibilă sintetizarea unei game largi de materiale polimerice cu o gamă largă de proprietăți. 
Toți acești compuși polimerici sunt utilizați pe scară largă într-o varietate de domenii ale activității umane - industrie, medicină, utilizați pentru fabricarea de echipamente pentru laboratoare biochimice, unii sunt intermediari pentru sinteza altor compuși cu molecul mare.
Oxidare
Știți deja că în soluții neutre sau ușor alcaline are loc oxidarea alchenelor în dioli (alcooli dihidroxilici). Într-un mediu acid (o soluție acidulată cu acid sulfuric), legătura dublă este complet distrusă, iar atomii de carbon între care a existat legătura dublă sunt transformați în atomi de carbon din grupa carboxil: 
Oxidarea distructivă a alchenelor poate fi utilizată pentru a determina structura lor. Deci, de exemplu, dacă se obțin acizi acetic și propionic în timpul oxidării unei anumite alchene, aceasta înseamnă că pentena-2 a suferit oxidare, iar dacă se obțin acid butiric și dioxid de carbon, atunci hidrocarbura originală este pentena-1 .
Aplicație
Alchenele sunt utilizate pe scară largă în industria chimică ca materii prime pentru producerea unei varietăți de substanțe și materiale organice.
De exemplu, etena este materia primă pentru producerea de etanol, etilen glicol, epoxizi și dicloroetan.
O cantitate mare de etenă este procesată în polietilenă, care este folosită pentru a face folii de ambalare, veselă, țevi și materiale electrice izolante.
Din propenă se obțin glicerina, acetona, izopropanolul și solvenții. Prin polimerizarea propenei se obtine polipropilena, care este superioara polietilenei in multe privinte: are un punct de topire mai mare si rezistenta chimica.
În prezent, fibrele cu proprietăți unice sunt produse din polimeri - analogi ai polietilenei. De exemplu, fibra de polipropilenă este mai puternică decât toate fibrele sintetice cunoscute.
Materialele realizate din aceste fibre sunt promițătoare și sunt din ce în ce mai utilizate în diverse domenii ale activității umane.

1. Ce tipuri de izomerie sunt caracteristice alchenelor? Scrieți formulele pentru posibilii izomeri ai pentenei-1.
2. Din ce compuşi se pot obţine: a) izobutenă (2-metilpropenă); b) buten-2; c) buten-1? Scrieți ecuațiile reacțiilor corespunzătoare.
3. Descifrează următorul lanț de transformări. Numiți compușii A, B, C. 4. Propuneți o metodă de obținere a 2-cloropropanului din 1-cloropropan. Scrieți ecuațiile reacțiilor corespunzătoare.
5. Sugerați o metodă pentru purificarea etanului de impuritățile de etilenă. Scrieți ecuațiile reacțiilor corespunzătoare.
6. Dați exemple de reacții care pot fi folosite pentru a face distincția între hidrocarburile saturate și nesaturate.
7. Pentru hidrogenarea completă a 2,8 g de alchenă s-au consumat 0,896 litri de hidrogen (n.e.). Care este greutatea moleculară și formula structurală a acestui compus, care are un lanț normal de atomi de carbon?
8. Ce gaz se află în cilindru (etenă sau propenă), dacă se știe că arderea completă a 20 cm3 din acest gaz a necesitat 90 cm3 (n.s.) de oxigen?
9*. Când o alchenă reacţionează cu clorul în întuneric, se formează 25,4 g de diclorură, iar când această alchenă de aceeaşi masă reacţionează cu bromul în tetraclorura de carbon, se formează 43,2 g de dibromură. Determinați toate formulele structurale posibile ale alchenei inițiale.
Istoria descoperirii
Din materialul de mai sus, am înțeles deja că etilena este strămoșul serii omoloage de hidrocarburi nesaturate, care are o dublă legătură. Formula lor este C n H 2n și se numesc alchene.
În 1669, medicul și chimistul german Becher a fost primul care a obținut etilenă prin reacția acidului sulfuric cu alcoolul etilic. Becher a descoperit că etilena este mai activă din punct de vedere chimic decât metanul. Dar, din păcate, la acel moment, omul de știință nu a putut identifica gazul rezultat și, prin urmare, nu i-a atribuit niciun nume.
Puțin mai târziu, chimiștii olandezi au folosit aceeași metodă pentru producerea etilenei. Și deoarece, atunci când interacționa cu clorul, acesta tindea să formeze un lichid uleios, a primit, în consecință, denumirea de „gaz petrolier”. Mai târziu s-a cunoscut că acest lichid era dicloroetan.
În franceză, termenul „ulei” este oléfiant. Și după ce au fost descoperite alte hidrocarburi de acest tip, Antoine Fourcroix, un chimist și om de știință francez, a introdus un nou termen care a devenit comun întregii clase de olefine sau alchene.
Dar deja la începutul secolului al XIX-lea, chimistul francez J. Gay-Lussac a descoperit că etanolul constă nu numai din gaz „petrol”, ci și din apă. În plus, același gaz a fost descoperit în clorură de etil.
Și deși chimiștii au stabilit că etilena constă din hidrogen și carbon și cunoșteau deja compoziția substanțelor, ei nu au putut găsi formula reală pentru o lungă perioadă de timp. Și abia în 1862 E. Erlenmeyer a reușit să demonstreze prezența unei duble legături în molecula de etilenă. Acest lucru a fost recunoscut și de omul de știință rus A.M Butlerov și a confirmat experimental corectitudinea acestui punct de vedere.
Apariția în natură și rolul fiziologic al alchenelor
Mulți oameni sunt interesați de problema unde pot fi găsite alchenele în natură. Deci, se dovedește că practic nu apar în natură, deoarece cel mai simplu reprezentant al său, etilena, este un hormon pentru plante și este sintetizat în ele doar în cantități mici.
Este adevărat că în natură există o astfel de alchenă ca muskalur. Aceasta dintre alchenele naturale este un atractant sexual al muștei de casă femele.
Merită să acordați atenție faptului că, având o concentrație mare, alchenele inferioare au un efect narcotic care poate provoca convulsii și iritații ale mucoaselor.
Aplicații ale alchenelor
Este dificil să ne imaginăm viața societății moderne de astăzi fără utilizarea materialelor polimerice. Deoarece, spre deosebire de materialele naturale, polimerii au proprietăți diferite, sunt ușor de prelucrat, iar dacă te uiți la preț, sunt relativ ieftini. Un alt aspect important în favoarea polimerilor este că mulți dintre ei pot fi reciclați.
Alchenele și-au găsit utilizarea în producția de materiale plastice, cauciucuri, filme, teflon, alcool etilic, acetaldehidă și alți compuși organici.

În agricultură, este folosit ca mijloc care accelerează procesul de coacere a fructelor. Propilena și butilena sunt folosite pentru a produce diferiți polimeri și alcooli. Dar în producția de cauciuc sintetic, se folosește izobutilenă. Prin urmare, putem concluziona că este imposibil să faceți fără alchene, deoarece acestea sunt cele mai importante materii prime chimice.
Utilizări industriale ale etilenei
La scară industrială, propilena este utilizată de obicei pentru sinteza polipropilenei și pentru producerea de izopropanol, glicerol, butiraldehide etc. În fiecare an, cererea de propilenă crește.

Continuare. Vezi începutul în № 15, 16, 17, 18, 19/2004
Lecția 9.
Proprietățile chimice ale alchenelor
Proprietățile chimice ale alchenelor (etilena și omologii săi) sunt determinate în mare măsură de prezența legăturilor d... în moleculele lor. Alchenele suferă toate cele trei tipuri de reacții, cele mai tipice reacții fiind p…. Să le luăm în considerare folosind exemplul propilenei C 3 H 6.
Toate reacțiile de adiție au loc de-a lungul unei duble legături și constau în scindarea legăturii alchenei și formarea a două noi legături la locul ruperii.
Adaos de halogen:

Adaos de hidrogen(reacție de hidrogenare):
Conexiune la apă(reacție de hidratare):

Adăugarea de halogenuri de hidrogen (HHal) și apă la alchene nesimetrice apare după regula lui V.V. Markovnikov (1869). Acid hidrogen Hhal se atașează de atomul de carbon cel mai hidrogenat la dubla legătură.În consecință, restul Hal se leagă de atomul de C, care are un număr mai mic de atomi de hidrogen.

Arderea alchenelor în aer.
Când sunt aprinse, alchenele ard în aer:
2CH 2 = CHCH 3 + 9O 2 6CO 2 + 6H 2 O.
Alchenele gazoase formează amestecuri explozive cu oxigenul atmosferic.
Alchenele sunt oxidate de permanganat de potasiu într-un mediu apos, care este însoțit de decolorarea soluției de KMnO 4 și formarea de glicoli (compuși cu două grupări hidroxil la atomi de C adiacenți). Acest proces - hidroxilarea alchenelor:

Alchenele sunt oxidate de oxigenul atmosferic în epoxizi când este încălzit în prezența catalizatorilor de argint:

Polimerizarea alchenelor– legarea multor molecule de alchenă între ele. Condiții de reacție: încălzire, prezența catalizatorilor. Unirea moleculelor are loc prin scindarea legăturilor intramoleculare și formarea de noi legături intermoleculare:

În această reacție intervalul de valori n = 10 3 –10 4 .
Exerciții.
1. Scrieți ecuațiile de reacție pentru buten-1 cu: a) Br2; b) HBr; V) H2O; G) H2. Numiți produșii de reacție.
2.
Sunt cunoscute condiții în care adăugarea de apă și halogenuri de hidrogen la legătura dublă a alchenelor are loc contrar regulii lui Markovnikov. Scrieți ecuațiile de reacție
3-bromopropilenă conform anti-Markovnikov cu: a) apă; b) bromură de hidrogen.
3.
Scrieţi ecuaţiile pentru reacţiile de polimerizare: a) buten-1; b) clorură de vinil CH2 =CHCI;
c) 1,2-difluoretilenă.
4. Întocmește ecuații pentru reacțiile etilenei cu oxigenul pentru următoarele procese: a) ardere în aer; b) hidroxilarea cu soluţie apoasă KMnO4; c) epoxidare (250 °C, Ag ).
5. Scrieți formula structurală a alchenei, știind că 0,21 g din acest compus pot adăuga 0,8 g brom.
6. Când se arde 1 litru de hidrocarbură gazoasă, decolorând soluția purpurie de permanganat de potasiu, se consumă 4,5 litri de oxigen și se obțin 3 litri. CO2. Scrieți formula structurală a acestei hidrocarburi.
Lecția 10.
Prepararea și utilizarea alchenelor
Reacțiile pentru producerea alchenelor se reduc la inversarea reacțiilor reprezentând proprietățile chimice ale alchenelor (ele merg de la dreapta la stânga, vezi lecția 9). Trebuie doar să găsiți condițiile potrivite.
Eliminarea a doi atomi de halogen din dihaloalcani care conțin halogeni la atomi de C vecini Reacția are loc sub influența metalelor (Zn etc.):

Cracarea hidrocarburilor saturate. Deci, la crăparea (vezi lecția 7) etan, se formează un amestec de etilenă și hidrogen:
Deshidratarea alcoolilor. Când alcoolii sunt expuși la agenți de îndepărtare a apei (acid sulfuric concentrat) sau când sunt încălziți la 350 °C în prezența catalizatorilor, apa este desprinsă și se formează alchene:
În acest fel, etilena este produsă în laborator.
O metodă industrială pentru producerea propilenei, împreună cu cracarea, este deshidratarea propanolului peste oxid de aluminiu:

Dehidroclorurarea cloroalcanilor se realizează sub acțiunea unei soluții alcaline în alcool, deoarece în apă, produșii de reacție nu sunt alchene, ci alcooli.
Aplicarea etilenei și a omologilor săi pe baza proprietăților lor chimice, adică a capacității de a se transforma în diferite substanțe utile.
Combustibili pentru motoare, având cifre octanice mari, se obțin prin hidrogenarea alchenelor ramificate:

Decolorarea unei soluții galbene de brom într-un solvent inert (CCl 4) are loc atunci când se adaugă o picătură de alchenă sau se trece un gaz alchenic prin soluție. Interacțiunea cu bromul – caracteristică reacție calitativă la o legătură dublă:
Produsul de clorurare a etilenei - cloroetanul - este utilizat în sinteza chimica pentru a introduce gruparea C 2 H 5 în moleculă:
Cloroetanul are, de asemenea, un efect de anestezie locală (calmarea durerii), care este utilizat în timpul operațiilor chirurgicale.
Prin hidratarea alchenelor se obțin alcooli, de exemplu, etanol:
Alcoolul C 2 H 5 OH este folosit ca solvent, pentru dezinfecție și în sinteza de noi substanțe.

Hidratarea etilenei în prezența agentului de oxidare [O] duce la etilenglicol – antigel și produs intermediar al sintezei chimice:

Oxidarea etilenei produce oxid de etilenă și acetaldehidă - materii prime in industria chimica:
![]()
Polimeri și materiale plastice– produse de polimerizare ai alchenelor, de exemplu, politetrafluoretilena (Teflon):
Exerciții.
1. Completați ecuațiile pentru reacțiile de eliminare (eliminare), numiți alchenele rezultate:
2.
Scrieți ecuațiile reacțiilor de hidrogenare ale: a) 3,3-dimetilbuten-1;
b) 2,3,3-trimetilbuten-1. Aceste reacții produc alcani folosiți ca combustibili pentru motoare, dați-le nume.
3. 100 g de alcool etilic au fost trecute printr-un tub care conține oxid de aluminiu încălzit. C2H5OH. Ca urmare, s-au obținut 33,6 litri de hidrocarbură (nr.). Cât de mult alcool (%) a reacționat?
4. Câte grame de brom vor reacționa cu 2,8 litri (nr.) de etilenă?
5. Scrieți o ecuație pentru reacția de polimerizare a trifluorcloretilenei. (Plasticul rezultat este rezistent la acid sulfuric fierbinte, sodiu metalic etc.)
Răspunsuri la exercițiile pentru subiectul 1
Lecția 9


5. Reacția alchenei C n H 2 n cu brom în formă generală:
![]()
Masa molară a alchenei M(CU n H 2 n) = 0,21 160/0,8 = 42 g/mol.
Aceasta este propilenă.
Răspuns.
Formula alchenei este CH2 = CHCH3 (propilenă).
6. Deoarece toate substanțele care participă la reacție sunt gaze, coeficienții stoichiometrici din ecuația de reacție sunt proporționali cu rapoartele lor volumetrice. Să scriem ecuația reacției:
CU A H V+ 4,5O23C02 + 3H2O.
Numărul de molecule de apă este determinat de ecuația reacției: 4,5 2 = 9 atomi de O reacționați, 6 atomi de O sunt legați în CO 2, restul de 3 atomi de O fac parte din trei molecule de H 2 O. Prin urmare, indicii sunt egali: A = 3, V= 6. Hidrocarbura dorită este propilena C3H6.
Răspuns.
Formula structurală a propilenei este CH2 = CHCH3.
Lecția 10
1. Ecuații pentru reacțiile de eliminare (eliminare) – sinteza alchenelor:

2. Reacții de hidrogenare ale alchenelor când sunt încălzite sub presiune în prezența unui catalizator:

3. Reacția de deshidratare a alcoolului etilic are forma:
![]()
Aici prin X indică masa de alcool transformată în etilenă.
Să găsim valoarea X: X= 46 33,6/22,4 = 69 g.
Proporția de alcool reacționat a fost: 69/100 = 0,69, sau 69%.
Răspuns.
69% alcool a reacţionat.
4.
![]()
Deoarece coeficienții stoichiometrici din fața formulelor substanțelor care reacţionează (C 2 H 4 și Br 2) sunt egali cu unitatea, este valabilă următoarea relație:
2,8/22,4 = X/160. De aici X= 20 g Br 2.
Răspuns.
20 g Br 2.
Proprietățile fizice ale alchenelor sunt similare cu cele ale alcanilor, deși toate au puncte de topire și de fierbere puțin mai mici decât alcanii corespunzători. De exemplu, pentanul are un punct de fierbere de 36 °C, iar pentena-1 - 30 °C. În condiții normale, alchenele C 2 - C 4 sunt gaze. C 5 – C 15 sunt lichide, începând de la C 16 sunt solide. Alchenele sunt insolubile în apă, dar foarte solubile în solvenți organici.
Alchenele sunt rare în natură. Deoarece alchenele sunt materii prime valoroase pentru sinteza organică industrială, au fost dezvoltate multe metode de preparare a acestora.
1. Principala sursă industrială de alchene este cracarea alcanilor care fac parte din ulei:
3. În condiții de laborator, alchenele se obțin prin reacții de eliminare, în care se elimină doi atomi sau două grupe de atomi din atomii de carbon vecini și se formează o legătură p suplimentară. Astfel de reacții includ următoarele.
1) Deshidratarea alcoolilor are loc atunci când sunt încălziți cu agenți de îndepărtare a apei, de exemplu cu acid sulfuric la temperaturi peste 150 ° C:
Când H 2 O este eliminat din alcooli, HBr și HCl din halogenuri de alchil, atomul de hidrogen este eliminat de preferință de cel al atomilor de carbon vecini care este legat de cel mai mic număr de atomi de hidrogen (din atomul de carbon cel mai puțin hidrogenat). Acest model se numește regula lui Zaitsev.
3) Dehalogenarea are loc atunci când dihalogenurile care au atomi de halogen la atomi de carbon adiacenți sunt încălzite cu metale active:
CH2Br -CHBr -CH3 + Mg → CH2 =CH-CH3 + Mg Br2.
Proprietățile chimice ale alchenelor sunt determinate de prezența unei duble legături în moleculele lor. Densitatea electronică a legăturii p este destul de mobilă și reacționează ușor cu particulele electrofile. Prin urmare, multe reacții ale alchenelor decurg în funcție de mecanism adiție electrofilă, desemnat prin simbolul A E (din engleză, adaos electrofil). Reacțiile de adiție electrofile sunt procese ionice care au loc în mai multe etape.
În prima etapă, o particulă electrofilă (cel mai adesea acesta este un proton H +) interacționează cu electronii p ai dublei legături și formează un complex p, care este apoi transformat într-un carbocation prin formarea unei legături s covalente între particula electrofilă și unul dintre atomii de carbon:
carbocation alchenic al complexului p
În a doua etapă, carbocationul reacționează cu anionul X, formând o a doua legătură s datorită perechii de electroni a anionului:

În reacțiile de adiție electrofile, un ion de hidrogen se atașează de atomul de carbon la legătura dublă care are o sarcină negativă mai mare. Distribuția sarcinii este determinată de schimbarea densității electronilor p sub influența substituenților:  .
.
Substituenții donatori de electroni care prezintă efectul +I schimbă densitatea electronului p la un atom de carbon mai hidrogenat și creează o sarcină negativă parțială asupra acestuia. Aceasta explică regula lui Markovnikov: atunci când se adaugă molecule polare precum HX (X = Hal, OH, CN etc.) la alchenele nesimetrice, hidrogenul se atașează de preferință la atomul de carbon mai hidrogenat la legătura dublă.
Să ne uităm la exemple specifice de reacții de adiție.
1) Hidrohalogenare. Când alchenele interacționează cu halogenuri de hidrogen (HCl, HBr), se formează halogenuri de alchil:
CH3-CH = CH2 + HBr® CH3-CHBr-CH3.
Produșii de reacție sunt determinati de regula lui Markovnikov.
Cu toate acestea, trebuie subliniat că, în prezența oricărui peroxid organic, moleculele polare de HX nu reacţionează cu alchenele conform regulii lui Markovnikov:
| R-O-O-R | ||
| CH3-CH = CH2 + HBr | CH3-CH2-CH2Br |
Acest lucru se datorează faptului că prezența peroxidului determină mecanismul radical și nu ionic al reacției.
2) Hidratarea. Când alchenele reacţionează cu apa în prezenţa acizilor minerali (sulfuric, fosforic), se formează alcooli. Acizii minerali acționează ca catalizatori și sunt surse de protoni. Adăugarea de apă urmează, de asemenea, regula lui Markovnikov:
CH3-CH=CH2 + HOH® CH3-CH(OH)-CH3.
3) Halogenare. Alchenele decolorează apa cu brom:
CH2 = CH2 + Br2® B-CH2-CH2Br.
Această reacție este calitativă pentru o legătură dublă.
4) Hidrogenarea. Adăugarea de hidrogen are loc sub acțiunea catalizatorilor metalici:
unde R = H, CH3, CI, C6H5 etc. Molecula CH 2 =CHR se numește monomer, compusul rezultat se numește polimer, numărul n este gradul de polimerizare.
Polimerizarea diverșilor derivați de alchenă produce produse industriale valoroase: polietilenă, polipropilenă, clorură de polivinil și altele.
Pe lângă în plus, alchenele suferă și reacții de oxidare. În timpul oxidării ușoare a alchenelor cu o soluție apoasă de permanganat de potasiu (reacția Wagner), se formează alcooli dihidroxilici:
ZSN2 =CH2 + 2KMnO4 + 4H2O® ZNOSN2-CH2OH + 2MnO2↓ + 2KOH.
Ca urmare a acestei reacții, soluția violetă de permanganat de potasiu se decolorează rapid și precipită un precipitat maro de oxid de mangan (IV). Această reacție, ca și reacția de decolorare a apei cu brom, este calitativă pentru o legătură dublă. În timpul oxidării severe a alchenelor cu o soluție de fierbere de permanganat de potasiu într-un mediu acid, legătura dublă este complet ruptă cu formarea de cetone, acizi carboxilici sau CO2, de exemplu:
| [DESPRE] | ||
| CH3-CH=CH-CH3 | 2CH3-COOH |
Pe baza produșilor de oxidare, se poate determina poziția dublei legături în alchena originală.
Ca toate celelalte hidrocarburi, alchenele ard și, cu mult aer, formează dioxid de carbon și apă:
CnH2n+Zn/2O2®nCO2+nH2O.
Când aerul este limitat, arderea alchenelor poate duce la formarea de monoxid de carbon și apă:
CnH2n + n02® nCO + nH20.
Dacă amestecați o alchenă cu oxigen și treceți acest amestec peste un catalizator de argint încălzit la 200°C, se formează un oxid de alchenă (epoxialcan), de exemplu:

La orice temperatură, alchenele sunt oxidate de ozon (ozonul este un agent oxidant mai puternic decât oxigenul). Dacă ozonul gazos este trecut printr-o soluție de alchenă în tetraclorura de metan la temperaturi sub temperatura camerei, are loc o reacție de adiție și se formează ozonidele corespunzătoare (peroxizi ciclici). Ozonidele sunt foarte instabile și pot exploda ușor. Prin urmare, de obicei nu sunt izolate, dar imediat după producție sunt descompuse cu apă - aceasta produce compuși carbonilici (aldehide sau cetone), a căror structură indică structura alchenei care a fost supusă ozonării.
Alchenele inferioare sunt materii prime importante pentru sinteza organică industrială. Alcoolul etilic, polietilena și polistirenul sunt produse din etilenă. Propena este utilizată pentru sinteza polipropilenei, fenolului, acetonei și glicerinei.
Pentru alchene, cele mai tipice reacții apar datorită deschiderii unei legături π mai slabe. În acest caz, legătura π (în alchena originală) este convertită într-o legătură σ în produsul de reacție. Compusul nesaturat inițial este transformat într-unul saturat fără formarea altor produse, de exemplu. se întâmplăreacție de adiție.
Care este mecanismul reacțiilor de adiție la alchene?
1. Datorită electronilor legăturii π, moleculele de alchenă au o regiune cu densitate electronică crescută (un nor de electroni π deasupra și sub planul moleculei):
Prin urmare, legătura dublă este predispusă să fie atacată de un reactiv electrofil (deficit de electroni). În acest caz, va avea loc clivarea heterolitică a legăturii π și reacția va continua ionic mecanism ca adiție electrofilă.
Mecanismul de adiție electrofilă este indicat prin simbol Anunțul E
(după primele litere ale termenilor englezi: Ad – adăugare [atașament],
E - electrofil [electrofil]).
2. Pe de altă parte, legătura carbon-carbon π, fiind nepolară, poate fi ruptă homolitic, iar apoi reacția va continua de-a lungul radical mecanism.
Mecanismul de adăugare a radicalilor este indicat prin simbol Anunțul R
(R – radical – radical).
Mecanismul de adăugare depinde de condițiile de reacție.
În plus, alchenele sunt caracterizate prin reacții izomerizareaȘi oxidare(inclusiv reacția ardere, caracteristic tuturor hidrocarburilor).
Reacții de adiție la alchene
Alchenele suferă o varietate de reacții de adiție.
1. Hidrogenarea (adăugarea de hidrogen)
Alchenele reacţionează cu hidrogenul când sunt încălzite şi sub presiune ridicată în prezenţa catalizatorilor (Pt, Pd, Ni, etc.) pentru a forma alcani:
Hidrogenarea alchenelor - reacție inversă dehidrogenarea alcanilor. Conform Principiul lui Le Chatelier, hidrogenarea este favorizată de presiunea crescută, deoarece această reacție este însoțită de o scădere a volumului sistemului.
Adăugarea de hidrogen la atomii de carbon din alchene duce la o scădere a stării lor de oxidare:
Prin urmare, hidrogenarea alchenelor este clasificată ca o reacție de reducere. Această reacție este utilizată industrial pentru a produce combustibil cu un octan ridicat.
2. Halogenare (adăugarea de halogeni)
Adăugarea de halogeni la dubla legătură C=C are loc ușor în condiții normale (la temperatura camerei, fără catalizator). De exemplu, decolorarea rapidă a culorii roșu-maroniu a unei soluții de brom în apă (apa cu brom) servește ca o reacție calitativă la prezența unei duble legături:
Astfel, în reacția HCI cu propilena, din doi posibili izomeri structurali 1-cloropropan și 2-cloropropan, acesta din urmă se formează:
Acest model a fost inițial stabilit empiric. În chimia organică modernă, o justificare teoretică pentru regula lui Markovnikov este dată pe baza poziției influenței structurii electronice a moleculelor asupra reactivității lor.
Trebuie remarcat faptul că regula lui Markovnikov în formularea sa clasică este respectată numai pentru reacțiile electrofile ale alchenelor în sine. În cazul unor derivați de alchenă sau când mecanismul de reacție se modifică, împotriva regulii Markovnikova.
4. Hidratarea(conexiune la apa)
Hidratarea are loc în prezența acizilor minerali prin mecanismul de adăugare electrofilă:
În reacțiile alchenelor nesimetrice, se respectă regula lui Markovnikov.
1. Polimerizare– reacția de formare a unui compus cu greutate moleculară mare (polimer) prin adăugarea secvențială a moleculelor unei substanțe cu greutate moleculară mică (monomer) conform schemei:
n M M n
Număr n în formula polimerului ( M n ) se numește grad de polimerizare. Reacțiile de polimerizare ale alchenelor apar datorită adăugării prin legături multiple:
2. Dimerizareaalchene - formarea unui dimer (moleculă dublă) ca urmare a unei reacții de adiție. În prezența unui acid mineral (donator de protoni H + ) se adaugă un proton la dubla legătură a moleculei de alchenă. Aceasta produce un carbocation:
„Carbocationul dimeric” este stabilizat prin eliberarea unui proton, ceea ce duce la produși de dimerizare alchenei - un amestec de diizobutilene izomerice (2,4,4-trimetilpenten-2 și 2,4,4-trimetilpenten-1) :
Acest proces are loc atunci când izobutilena (2-metilpropenă) este tratată cu acid sulfuric 60% la o temperatură de 70°C. Amestecul rezultat de diizobutilene este hidrogenat pentru a produce „izooctan” (2,2,4-trimetilpentan), care este utilizat pentru a îmbunătăți capacitatea anti-detonare a benzinei („izooctanul” este un combustibil standard de 100 octan).
Alchenele sunt active chimic. Proprietățile lor chimice sunt în mare măsură determinate de prezența unei duble legături. Cele mai frecvente reacții pentru alchene sunt reacțiile de adiție electrofilă și de adiție radicalică. Reacțiile de adiție nucleofile necesită de obicei prezența unui nucleofil puternic și nu sunt tipice pentru alchene. Alchenele suferă ușor reacții de oxidare și adiție și sunt, de asemenea, capabile de substituție cu radicali alil.
Reacții de adaos
Hidrogenarea Adăugarea de hidrogen (reacție de hidrogenare) la alchene se realizează în prezența catalizatorilor. Cel mai adesea, se folosesc metale zdrobite - platină, nichel, paladiu etc. Ca urmare, se formează alcanii corespunzători (hidrocarburi saturate).
$CH_2=CH_2 + H2 → CH_3–CH_3$
Adăugarea de halogeni. Alchenele reacționează ușor, în condiții obișnuite, cu clorul și bromul pentru a forma dihaloalcanii corespunzători, în care atomii de halogen sunt localizați la atomii de carbon adiacenți.
Nota 1
Când alchenele reacţionează cu bromul, bromul devine decolorat la o culoare galben-maro. Aceasta este una dintre cele mai vechi și mai simple reacții calitative pentru hidrocarburile nesaturate, deoarece alchinele și alcadienele reacționează, de asemenea, în mod similar.
$CH_2=CH_2 + Br_2 → CH_2Br–CH_2Br$
Adăugarea de halogenuri de hidrogen. Când hidrocarburile de etilenă interacționează cu halogenuri de hidrogen ($HCl$, $HBr$), se formează haloalcani direcția reacției depinde de structura alchenelor.
În cazul etilenei sau alchenelor simetrice, reacția de adiție are loc fără ambiguitate și duce la formarea unui singur produs:
$CH_2=CH_2 + HBr → CH_3–CH_2Br$
În cazul alchenelor nesimetrice, este posibilă formarea a doi produși diferiți de reacție de adiție:
Nota 2
De fapt, în principal se formează un singur produs de reacție. Modelul în direcția unor astfel de reacții a fost stabilit de chimistul rus V.V. Markovnikov în 1869 Se numește regula lui Markovnikov. Când halogenurile de hidrogen reacționează cu alchene nesimetrice, se adaugă un atom de hidrogen la locul clivajului dublei legături pe atomul de carbon cel mai hidrogenat, adică înainte de a fi conectat la un număr mare de atomi de hidrogen.
Markovnikov a formulat această regulă pe baza datelor experimentale și abia mai târziu a primit o justificare teoretică. Luați în considerare reacția propilenei cu acid clorhidric.
Una dintre caracteristicile obligațiunii $p$ este capacitatea sa de a fi ușor polarizată. Sub influența grupării metil (efect inductiv pozitiv + $I$) din molecula de propenă, densitatea electronică a legăturii $p$ se deplasează la unul dintre atomii de carbon (= $CH_2$). Ca rezultat, apare o sarcină negativă parțială ($\delta -$). O sarcină pozitivă parțială ($\delta +$) apare pe celălalt atom de carbon al legăturii duble.
Această distribuție a densității electronilor în molecula de propilenă determină locația viitorului atac de protoni. Acesta este atomul de carbon al grupării metilen (= $CH_2$), care poartă o sarcină negativă parțială $\delta-$. Și clorul, în consecință, atacă un atom de carbon cu o sarcină pozitivă parțială $\delta+$.
În consecință, principalul produs al reacției propilenei cu acid clorhidric este 2-cloropropanul.
Hidratarea
Hidratarea alchenelor are loc în prezența acizilor minerali și se supune regulii lui Markovnikov. Produșii de reacție sunt alcooli
$CH_2=CH_2 + H_2O → CH_3–CH_2–OH$
Alchilare
Adăugarea de alcani la alchene în prezența unui catalizator acid ($HF$ sau $H_2SO_4$) la temperaturi scăzute duce la formarea de hidrocarburi cu o greutate moleculară mai mare și este adesea folosită în industrie pentru a produce combustibil pentru motor.
$R–CH_2=CH_2 + R’–H → R–CH_2–CH_2–R’$
Reacții de oxidare
Oxidarea alchenelor se poate produce, în funcție de condițiile și tipurile de reactivi oxidanți, atât cu clivajul dublei legături, cât și cu conservarea scheletului de carbon:
Reacții de polimerizare
Moleculele de alchenă sunt capabile să se adauge unele la altele în anumite condiții cu deschiderea legăturilor $\pi$ și formarea de dimeri, trimmeri sau compuși cu greutate moleculară mare - polimeri. Polimerizarea alchenelor poate avea loc fie printr-un radical liber, fie printr-un mecanism cation-anion. Acizii, peroxizii, metalele etc. sunt utilizați ca inițiatori de polimerizare. Reacția de polimerizare se realizează și sub influența temperaturii, iradierii și presiunii. Un exemplu tipic este polimerizarea etilenei pentru a forma polietilenă
$nCH_2=CH_2 → (–CH_2–CH_(2^–))_n$
Reacții de substituție
Reacțiile de substituție nu sunt tipice pentru alchene. Cu toate acestea, la temperaturi ridicate (peste 400 ° C), reacțiile de adiție de radicali, care sunt reversibile, sunt suprimate. În acest caz, devine posibilă înlocuirea atomului de hidrogen situat în poziția alilic, menținând în același timp legătura dublă.
$CH_2=CH–CH_3 + Cl_2 – CH_2=CH–CH_2Cl + HCl$