КАЛЬЦИЙ (Calcium, Ca ) - химический элемент II группы периодической системы Д. И. Менделеева, относится к щелочноземельным металлам; обладает высокой биологической активностью, является основным структурным компонентом костей скелета и зубов животных и человека, а также важном компонентом системы свертывания крови; соли К., поступая в составе пищи и усваиваясь организмом, существенно влияют на обмен веществ, т. е. К. является незаменимым элементом в питании человека. Соединения К. укрепляют защитные силы организма и повышают его устойчивость к внешним неблагоприятным факторам, в т. ч. и к инфекциям. Некоторые соли К. используются как лекарственные средства. Недостаточность или избыток К. в организме может быть причиной или следствием ряда патол, состояний (см. Кальциноз , Кальцифилаксия , Остеомаляция , Рахит).
Порядковый номер К. 20, атомный вес 40,08; природный К. состоит из смеси шести стабильных изотопов, из которых наиболее распространен 40 Ca.
Металлический К. впервые выделен в 1808 г. Дэви (Н. Davy), который и назвал новый элемент кальцием (лат. calx известь). К. широко распространен в природе, его соединения - известняк, мрамор, гипс (см.), известь (см.) с глубокой древности использовались в качестве строительного материала. По распространенности в природе К. занимает пятое место.
Плотность К. при t° 20° равна 1,54 г/см 3 , теплопроводность при t° 20° - 0,3 кал/см-град-сек, уд. теплоемкость (0-100°)- 0,149 кал/г-град, уд. сопротивление при t° 20°- 4,6*10 -6 ом-см. В соединениях К. двухвалентен, химически весьма активен. При обычной температуре К. легко взаимодействует с кислородом и влагой воздуха. При нагревании на воздухе или в присутствии кислорода образует окись - CaO. Взаимодействуя с холодной водой, образует гидроокись - Ca(OH) 2 . К. реагирует с галогенами - фтором (на холоду), хлором и бромом (при температуре выше 400°), образуя соответственно CaF 2 , CaCl 2 , CaBr 2 . При нагревании без доступа воздуха с графитом, кремнием и фосфором К. образует соответственно CaC 2 , Ca 2 Si, CaSi и Cs 3 P 2 , а с металлами (Al, Ag, Cu, Mg, Pb, Sn и др.) К. дает интерметаллические соединения.
К. способен образовывать прочные соединения с белками, фосфолипидами, органическими к-тами. Благодаря этим свойствам К. не только выполняет важную пластическую роль при формировании тканевых структур, но и влияет на многие физиол, и биохим, процессы, постоянно протекающие в организме человека и! животных, участвуя в регуляций проницаемости клеточных мембран, в электрогенезе нервной, мышечной и железистой тканей, в процессах синаптической передачи, молекулярном механизме мышечного сокращения, в осуществлении секреторного и инкреторного процессов пищеварительными и эндокринными железами, а также контролирует ряд ферментативных процессов.
Содержание К. в организме взрослого человека составляет ок. 20 г на 1 кг веса тела; у новорожденных - ок. 9 г на 1 кг. Основная часть К. (99%) содержится в костной и хрящевой тканях (см. Кость , Хрящевая ткань) и в зубах (см.). В этих тканях К. обнаруживается в виде карбоната, кальцийфосфата, соединений с хлором, органическими к-тами и др., остальная часть - внутри клеток мягких тканей и во внеклеточной жидкости. Концентрация К. в плазме крови человека и большинства млекопитающих составляет ок. 10 мг% (2,5 мМ). К. плазмы представлен двумя фракциями: диффундирующей (комплексы К. с белками) и не диффундирующей (ионизированный К. и комплексы К. с к-тами). В плазме крови К. связан с четырьмя фракциями фосфата - белковой, липидной, кислоторастворимой и органической. На долю К., образующего комплексы с белками, приходится одна треть общего количества К. плазмы крови (концентрация 0,82 мМ). Наибольшей кальцийсвязывающей способностью обладают альбумины, бета-глобулины и цефалин. Комплексы К. с белками в плазме крови служат своего рода депо К. в организме. Концентрация ионизированного К. в плазме составляет 1,33 мМ, а комплексов К. с фосфатами, карбонатами, цитратами и анионами других органических к-т - 0,3 мМ.
В 1 г белка форменных элементов крови содержится 2,5*10 -4 моля К. Высокой кальцийсвязывающей способностью обладают мембраны эритроцитов, активный обмен К. происходит в тромбоцитах. К. является необходимым фактором в процессе свертывания крови: в отсутствие К. не происходит превращения протромбина в тромбин, а кровь, стабилизированная добавлением соединений, связывающих ионы К. (напр., оксалата или цитрата натрия), не свертывается (см. Свертывающая система крови).
В клетках основная часть К. связана с белками и фосфолипидами клеточных мембран и мембран органелл. В ядрах К. больше, чем в цитоплазме. Наиболее богаты К. ядра клеток печени, поджелудочной и вилочковой желез. Способностью накапливать, а в случае надобности освобождать ионы К. обладают митохондрии. Процесс аккумуляции ионов К. сопряжен с переносом электронов и накоплением неорганического фосфата. При этом не происходит окислительного фосфорилирования: энергия переноса электронов может использоваться митохондрией либо для накопления ионов К., либо для синтеза АТФ, но не для обоих этих процессов одновременно. Кальцийаккумулирующая способность митохондрий дает им возможность участвовать в процессах биол, кальцинирования й декальцинирования, а также в расслаблении мышц.
При действии ПТГ повышается концентрация К. и снижается содержание фосфора в плазме крови. ПТГ и витамин D действуют синергично. Вызванная введением ПТГ гиперкальциемия связана с повышением клеточной активности остеокластов и обусловленной этим усиленной резорбцией кости. Кость является главным местом приложения ПТГ. Под влиянием ПТГ происходит рассасывание костной ткани за счет растворения как минерального, так и органического компонентов матрицы кости. ПТГ усиливает реабсорбцию К. в почечных канальцах. При недостатке ПТГ развивается гиперкальциурия. Под действием ПТГ усиливается всасывание К. из кишечника. Секреция ПТГ резко усиливается при гипокальциемии. Антагонистом ПТГ в отношении влияния на обмен К. является КТ. Секреция КТ возрастает с повышением концентрации К. в плазме крови. При действии КТ в крови уменьшается содержание К. и число остеокластов; предупреждается остеопороз. КТ предотвращает кальцификацию сердца, почек и других органов и способствует положительному кальциевому балансу в костях. При введении КТ усиливается выделение фосфора почками. Нормальная секреция КТ приобретает особенно важное значение с точки зрения поддержания кальциевого баланса в периоды голодания, лактации, длительной иммобилизации больных, гиподинамии.
Регуляция обмена К. ПТГ и КТ связана с действием гормонов гипофиза, коры надпочечников и щитовидной железы. На обмен К. существенное влияние оказывают также глюкокортикоиды и минералокортикоиды. При гиперфункции надпочечников усиливается выведение К. с мочой и калом. Глюкокортикоидные гормоны ослабляют гипокальциемическое влияние КТ. Под влиянием соматотропного гормона наряду с усилением синтеза белков и замедлением выведения фосфора, азота и натрия повышается всасывание К. в кишечнике. Последнее обусловлено стимуляцией образования цитрата, который является одним из важных факторов системы транспорта К. Гормон роста оказывает существенное влияние не только на костную, но и на другие ткани организма. Поддержание кальциевого гомеостаза координируется ц. н. с. и в. н. с. Особая роль в центральной регуляции кальциевого обмена отводится гипоталамо-гипофизарной системе. Последняя оказывает влияние практически на все эндокринные железы, в первую очередь - на паращитовидные и щитовидную. Определенная роль отводится клеткам эпифиза. Физиологически активные вещества, выделяемые этими клетками, прежде всего серотонин, влияют на обмен К.
Изменения содержания К. в плазме крови проявляются в виде гиперкальциемии или гипокальциемии. В норме в плазме крови содержится 8,5-12,0 мг% К., у детей (новорожденных) - 7,5-13,9 мг%. Синдром гиперкальциемии (см.) проявляется задержкой роста, анорексией, рвотой, запорами, жаждой и полиурией, гипотонией мышц и гипер-рефлексией. При тяжелых формах выявляется нефрокальциноз и артериальная гипертензия. При длительной гиперкальциемии развивается кальциноз сосудов почек (см. Кальциноз). При гиперкальциемии любой этиологии развивается кератопатия и даже кальцификация роговицы глаза. По данным В. М. Боголюбова, иногда наблюдаются нарушения со стороны ц. н. с., выражающиеся в спутанности сознания, летаргии, провалах памяти. На ЭКГ отмечается уменьшение зубца Р, увеличение длительности отрезка QT и систолического показателя.
Гиперкальциемия возникает при избыточном приеме солей К., при повышенном всасывании К. из кишечника и при снижении выведения его через почки. Гиперкальциемия встречается при целом ряде заболеваний. Так, она возникает при повышенном потреблении витамина D за счет избыточного всасывания К. из жел.-киш. тракта. Гиперкальциемия часто осложняет системный саркоидоз костей и множественную миелому, проявляясь эпизодически или постоянно. Основой гиперкальциемии при этом также служит повышенное всасывание К. из жел.-киш. тракта. Гиперкальциемия часто сопровождает болезнь Иценко - Кушинга, акромегалию, гипотиреоз г злокачественные опухоли легкого, молочной железы, яичек, почек, желчного пузыря, желудка, особенно когда имеются метастазы в кости. Гиперкальциемия является основным признаком гиперпаратиреоидизма. Только в редких случаях, при выраженном ацидозе, гиперпаратиреоидизм протекает без гиперкальциемии. При гиперпаратиреоидизме быстро поражаются мочевыводящие пути. Обычно при всех заболеваниях, протекающих с гиперкальциемией, выявляется и гиперкальциурия. Исключение составляет гиперкальциемия при гиперпаратиреоидизме и миеломной болезни, когда гиперкальциурия наблюдается редко. Из заболеваний, не сопровождающихся гиперкальциемией, гиперкальциурия наблюдается при отравлении бериллием, избыточном приеме кортикостероидов, при гепатолентикулярном синдроме.
Гипокальциимия клинически проявляется тетанией (см.), к-рая является клин, синдромом, характеризующимся состоянием повышенной возбудимости нервной системы. Диагностика гипокальциемии основывается на данных анамнеза, результатах клин, и лабораторных исследований. Обращается внимание на наличие в прошлом судорожных приступов и на состав принимаемой пищи. Диагноз подтверждают показатели содержания К. и фосфора в крови. Концентрация К., особенно его ионизированной формы, снижена, а фосфора - повышена.
Гипокальциемия наблюдается также при гипопаратиреоидизме, при идиопатической тетании (спазмофилии), при нарушении всасывательной способности жел.-киш. тракта вследствие его поражения или недостаточного выделения желчи в кишечник, при хрон, почечной недостаточности, при сахарном диабете, при синдроме Фанкони - Альбертини, гиповитаминозе D. При идиопатической тетании заболевание протекает хронически, с обострениями в весенний и осенний периоды. При этом часто наблюдаются изменения трофического порядка, катаракта, выкрашивание зубов, выпадение волос.
Терапия гипер- и гипокальциемии определяется, как правило, основным заболеванием.
Кальций радиоактивный
Известны 8 искусственных радиоактивных изотопов К.: 37 Са (Т1/2 0,17 сек.), 38 Са (T1/2 0,66 сек.), 39 Са (Т1/2 0,86 сек.), 41 Са (Т1/2 8*10 4 лет), 45 Са (Т1/2 153 дня), 47 Са (T1/2 4,7 дня), 49 Ca (Т1/2 8,5 мин.), 50 Са (Т1/2 9 сек.).
Практическое применение нашли 45 Ca, обладающий бета-излучением с энергией 0,252 Мэв, и 47 Са с бета-излучением двух энергий (0,67 и -2 Мэв) и гамма-излучением с энергией 1,3 Мэв, сопровождающим 74% распадов этого радионуклида.
45 Ca получают в ядерном реакторе при облучении стабильного К. нейтронами. Этот радионуклид широко применяется в качестве радиоактивной метки в медицине и в экспериментальных медико-биол. исследованиях при изучении всасывания К. в кишечнике и распределения его в организме в норме и патологии, а также путей и скорости выведения К. из организма при разных способах поступления. Особенно широко используется 45 Ca при изучении биохимии кости, а также механизмов трансплацентарного обмена. Метка 45 Ca используется также в металлургии, в сельском хозяйстве - для решения вопросов движения влаги в почве, выщелачивания К. из почвы, оценки способов внесения удобрений и т. п. Реже в качестве радиоактивной метки применяют 47 Са, получаемый на ускорителе. Этот радионуклид обладает тем преимуществом, что его 7-излучение легче поддается измерению, чем бета-излучение 45 Ca; кроме того, имея более короткий период полураспада, он менее токсичен. В методе нейтронного активационного анализа используется образование других изотопов К., в частности 49 Са.
Среднегодовая допустимая концентрация в воздухе рабочих помещений установлена: для 45 Ca - 3,2*10 -11 , для 47 Са - 1,7*10 -10 кюри/л. Минимально значимая активность на рабочем месте, не требующая регистрации или получения разрешения органов Государственного сан. надзора, для обоих радионуклидов равна 10 мккюри.
Препараты кальция
Препараты К. применяют для заместительной терапии при дефиците К. в организме. При острой недостаточности К. (тетания, спазмофилия) их используют в комбинации с ПТГ, при хрон, недостаточности К. (рахит, остеомаляция) - с витамином D. Недостаточность К. в организме может возникнуть при его большом расходе (рост, лактация, беременность), а также при пищевом режиме с недостаточным содержанием К. (картофель, хлеб, мясо). В этих условиях препараты К. принимают профилактически или добавляют в пищевые продукты. В связи с тем, что К. участвует в обмене веществ в костной ткани и зубов, его применяют иногда для улучшения сращения переломов, профилактики кариеса, для предотвращения остеопороза и т. д.
Препараты К. применяют при легочных, носовых, маточных и других кровотечениях, однако лечение препаратами К. эффективно только в том случае, когда в организме существует дефицит К., т. к. обычно в организме достаточно К. для обеспечения нормального процесса свертывания крови. При переливании больших количеств консервированной крови (500 мл и более), в к-рую добавляется цитрат (для предотвращения свертывания), необходимо внутривенное введение препаратов К., поскольку находящиеся в свободном виде анионы цитрата способны связать К. реципиента, в результате чего может возникнуть гипокоагуляция, ослабление деятельности сердца и т. д.
Препараты К. применяют также при состояниях, не связанных с кальциевой недостаточностью. К. действует на ц. н. с. успокаивающе, в больших дозах он подавляет нервно-мышечную передачу. К. усиливает сердечную деятельность, повышает артериальное давление, уменьшает спазмы бронхов и жел.-киш. тракта, тонизирует матку, уменьшает мембранную проницаемость, действуя противовоспалительно, противоэкссудативно, десенсибилизирующе.
Препараты К. применяются при неврозах, мигрени, головных болях после спинномозговой пункции, комплексном лечении эпилепсии и т. д. В эксперименте К. может ослабить судороги, вызванные аналептиками (коразолом, стрихнином и др.). К. может восстанавливать пониженную возбудимость нервных клеток в тех случаях, когда нарушения связаны с изменением ионного баланса. Так, К. снимает угнетающее влияние ионов магния на ц. н. с. Введение К. способствует восстановлению функций организма после общей анестезии, при интоксикациях нейролептиками и другими веществами, угнетающими ц. н. с. К. включают в противошоковые жидкости, применяют в хирургии для профилактики операционной гипотензии. В этих случаях имеет значение его влияние на сердечную деятельность, артериальное давление и т. д. Стимулирующее действие К. используют при заболеваниях сердца, сопровождающихся отеками или ослаблением тонуса миокарда.
Препараты К. усиливают функцию надпочечников и повышают содержание адреналина в крови. Они применяются при комплексном лечении бронхиальной астмы. Противоаллергическое действие препаратов К. связано с их противовоспалительным действием, стимуляцией выброса адреналина надпочечниками, а также способностью К. снижать высвобождение гистамина (см.) при аллергических реакциях. На реакции антиген - антитело К. не влияет. Препараты К. применяют как противовоспалительные при комплексном лечении пневмоний, плевритов, эндометритов и т. д., для профилактики послеоперационных воспалительных процессов. В качестве десенсибилизирующих средств К. используется при крапивнице, ангионевротическом отеке, сывороточной болезни, лекарственной аллергии. В этих случаях рационально применение его препаратов совместно с антигистаминными препаратами, т. к. К. не обладает антигистаминными свойствами.
Препараты К. применяются для осмотерапии при отеке мозга, при черепно-мозговой травме и т. д. К. снижает проникновение жидкой части крови в ткани, способствует оттоку жидкости из ткани в кровь.
К. активирует ретикулоэндотелиальную систему и фагоцитарную функцию лейкоцитов. Его препараты используют при комплексном лечении инфекционных заболеваний.
Препараты К. малотоксичны, однако при большой скорости их введения в вену может развиться интоксикация. При этом наступает фибрилляция желудочков сердца, позже - сердечно-сосудистая недостаточность и поражение почек вследствие интенсивного выведения К. Были описаны аллергические реакции на введение препаратов К. разной интенсивности. К. противопоказан при тромбозе, атеросклерозе и гиперкальциемии, при индивидуальной повышенной чувствительности к его препаратам. К. следует осторожно применять при лечении сердечными гликозидами, действие которых он усиливает.
Кальция хлорид , Calcii chloridum, CaCl 2 -6H 2 O. Бесцветные, горьковатые на вкус, гигроскопичные, расплывающиеся на воздухе кристаллы, хорошо растворимые в воде (4: 1), хуже - в спирте (1: 9); содержит 27% К. Местно действует раздражающе (1-2% р-р), а в больших концентрациях - некротизирующе (10-15% р-р). Кальция хлорид применяется при всех показаниях для кальциотерапии. При назначении кальция хлорида внутрь он действует по принципу кислотообразующих диуретиков и поэтому может быть использован в некоторых случаях для усиления мочеотделения.
Свойство кальция хлорида вызывать некрозы при внутрикожной или подкожном введении используют для рефлекторной стимуляции трофических процессов. Его вводят внутрикожно для создания мелко-очаговых некрозов в коже спины, конечностей и т. д. для получения рефлекторных реакций с места раздражения (снятие послеоперационных контрактур рефлекторным путем, лечение хрон, воспаления и т. п.). Кальция хлорид применяют как противоядие при отравлении фторидами и оксалатами с целью образования недиссоциирующих нетоксичных соединений К., не способных всасываться в кишечнике. Кальция хлорид назначают внутрь и внутривенно. Т. к. К. медленно всасывается из жел.-киш. тракта, его внутривенное введение наиболее эффективно.
Внутрь употребляют 5-10% р-ры кальция хлорида (запивают молоком), а внутривенно - 10% р-ры (в ампулах по 5 и 10 мл). Кальция хлорид используется для электрофореза. При введении кальция хлорида в вену появляется кратковременное ощущение тепла, жара, возникающее сначала в полости рта, а затем распространяющееся по всему телу, брадикардия, тошнота. Эти явления можно объяснить тем, что К. способствует высвобождению гистамина из тканей. Этой особенностью реакции на введение кальция хлорида пользуются для определения скорости кровотока.
Форма выпуска: порошок в хорошо укупоренных стеклянных банках и в ампулах по 5 и 10 мл 10% р-ра. Хранят порошок в сухом месте.
Calcii gluconas, кальциевая соль глюконовой к-ты:
Белый зернистый порошок, растворяется в холодной (1: 50) и в кипящей воде (1: 5), нерастворим в спирте; содержит 9% К. В отличие от кальция хлорида, оказывает менее выраженное местное раздражающее действие. Резорбтивное действие по сравнению с кальция хлоридом выражено слабее и возникает медленнее в связи с меньшим содержанием К. в препарате. Употребляется внутрь, подкожно, внутримышечно и внутривенно. Терапевтические дозы в 2-3 раза выше, чем у кальция хлорида. Внутривенно вводится в виде 10% р-ра. Внутрь употребляется в порошках и таблетках по 2,0- 5,0 г 2-3 раза в день. Применяется также для ионофореза и индуктофореза. Побочные эффекты возникают редко.
Формы выпуска: порошок, таблетки по 0,5 г и ампулы по 10 мл 10% р-ра.
Calcii lactas, молочно-кислый кальций:

Белый мелкий порошок слабогорького вкуса, слабо растворяется в холодной воде (1: 20), в горячей - легче; содержит 13% К. Применяется в тех же случаях, что и кальция хлорид,- но, в отличие от последнего, не обладает местным раздражающим действием и не вызывает ацидоза, наоборот, увеличивает щелочной резерв, что используется для устранения уже развившегося ацидоза. Более эффективен фармакологически, чем кальция глюконат, т. к. содержит больше К. Употребляется внутрь по 0,5-1,0 г или же стол, ложками в виде 5% р-ра 2-3 раза в день.
Формы выпуска: порошок и таблетки по 0,5 г.
Хранят в хорошо укупоренной таре.
Кальция глицерофосфат , Calcii glycerophosphas, глицерино-фосфорно-кальциевая соль; смесь альфа- и бета-изомеров:
CaPO 3 -О-C 3 H 5 (OH) 2 -nH 2 O
Белый порошок без запаха, слабогорького вкуса. Растворим в разведенной соляной к-те, нерастворим в воде и спирте.
Применяют как общеукрепляющее и тонизирующее средство при пониженном питании, переутомлении, истощении нервной системы, рахите. Усиливает анаболические процессы; действующим началом в препарате является фосфор
Назначают внутрь взрослым по 0,2-0,5 г, детям по 0,05-0,2 г на прием 2-3 раза в день (часто в сочетании с препаратами железа, мышьяка и со стрихнином).
Формы выпуска: порошок и таблетки по 0,2 и 0,5 г, гранулы во флаконах по 100 г.
Хранят в хорошо укупоренной таре.
Кальция карбонат осажденный , Calcii carbonas praecipitatus, CaCO 3 , обладает антацидными свойствами - см. Мел .
Методы определения кальция в биологических жидкостях
Общий К. (ионизированный и белково-связанный) в биол, жидкостях определяют прямыми и косвенными методами.
Косвенные методы заключаются в предварительном осаждении К. (оксалатом аммония, хлоранилатом, пикроланатом) из исследуемой жидкости; наиболее правильные результаты получают при применении оксалата аммония. После осаждения К. определяют гравиметрически, титрометрически, колориметрически.
При гравиметрическом определении К. осаждают (при нагревании в слабощелочной среде) в виде труднорастворимого оксалата кальция. Осадок оставляют стоять не менее 2-3 час., отфильтровывают, промывают несколько раз 0,1- 0,5% р-ром оксалата аммония, прокаливают при 1000-1200° и взвешивают окись кальция (фактор пересчета окиси кальция на кальций равен 0,7146). Метод отличается трудоемкостью.
При титрометрическом определении осадок оксалата кальция растворяют в серной (метод Ваарда) или в соляной (метод Крамера - Тисдалла) к-те и освободившуюся щавелевую к-ту оттитровывают, чаще всего перманганатом калия. Визуальная оценка результатов обусловливает плохую воспроизводимость титрометрических методов (коэффициент вариации >10%).
Прямые методы более точны, т. к. исключают ошибки, связанные с осаждением кальция и растворением осадка. К прямым относятся методы комплексонометрического титрования в присутствии металлиндикаторов (см. Комплексонометрия). В качестве комплексона обычно употребляют ЭДТА или ЭГТА (этиленгликольбисаминоэтилтетрауксусную к-ту). При комплексонометрическом титровании наиболее часто в качестве индикатора применяется мурексид (см. Гринблатта-Хартмена метод). Р-р мурексида и кальциево-мурексидный комплекс - нестойкие соединения. Визуальное установление конечной точки титрования неточно. Поэтому в ряде методов титрования с мурексидом проводят фотометрически.
При работе с флюорексоном в качестве индикатора количество сыворотки крови уменьшают до 0,1 мл (100 мкл); при титровании в точке эквивалентности отмечается исчезновение флюоресценции. Этот метод предложен в 1959 г. болгарскими врачами Е. Вичевым и А. Каракашовым.
Более четкое изменение окраски достигается при применении в качестве индикаторов кислотного хрома темно-синего, кальциона, гидрона II, глиоксаль-бис-2-оксианила, позволяющих также количественно определять К. без отделения магния. Р-ры индикаторов устойчивы, за исключением глиоксаль-бис-2-оксианила.
Из прямых методов наиболее точными являются колориметрические методы: ализариновые, с метилтимоловым синим, с о-крезолфталеинкомплексоном, с глиоксаль-бис-2-оксианилом.
Ализариновые методы чувствительны, могут применяться в микро-варианте, но трудоемки.
Метод определения с метилтимоловым синим также характеризуется высокой чувствительностью, стабильностью кальциевого комплекса, однако имеет небольшой интервал линейности калибровочного графика (до 3 ммоля/л, т. е. до 12 мг%).
При определении кальция с о-крезолфталеин-комплексоном цветной комплекс быстро образуется в щелочной среде, стабилен в течение длительного времени, не чувствителен к температурным воздействиям, но недостаточно специфичен. Для исключения интерференции магния и влияния ионов тяжелых металлов на определение К. вводят в состав о-крезолфталеин-комплексонового реактива 8-оксихинолин, цианистый калий или сульфат натрия, ацетат натрия, диэтеноламин. Метод дает хорошо воспроизводимые результаты: коэффициент вариации 1,9%.
Глиоксаль-бис-2-оксианил образует с К. в щелочной среде комплекс, окрашенный в красный цвет. Интенсивность окраски прямо пропорциональна концентраций К. Реакция высокочувствительна и специфична. Для стабилизации цветного комплекса используют метанол или метанол - ацетон.
Флюориметрические методы (см. Флюориметрия) основаны на избирательной флюоресценции комплекса кальцеина (флюорексона) с К. и позволяют работать с ультрамикроколичествами (20 мкл) сыворотки крови.
Гистохим, методы выявления К. и его солей - см. Коссы способы .
Библиография: Биохимические методы исследования в клинике, под ред. А. А. Покровского, с. i 8 и др., М., 1969; Боголюбов В. М. Патогенез и клиника водно-электролитных расстройств, Л., 1968, библиогр.; Болдырев А. А. Биохимические аспекты электромеханического сопряжения, с. 78, М., 1977, библиогр.; Иванов И. И., Коровкин Б. Ф. и Пинаев Г. П. Биохимия мышц, М., 1977; Материалы по токсикологии радиоактивных веществ, под ред. А. А. Летавета и Э. Б. Курляндской, в. 6, М., 1968; Машковский М. Д. Лекарственные средства, ч. 2, с. 79 и др., М., 1977; Метаболизм миокарда, под ред. Е. Чазова и Ю. Браунвальда, с. 178, М., 1975; Нормы радиационной безопасности (НРБ-76), М., 1978; P о м а н e н к о В. Д. Физиология кальциевого обмена, Киев, 1975, библиогр.; Тодоров Й. Клинические лабораторные исследования в педиатрии, пер. с болг., София, 1968, библиогр.; Calcium, phosphate and magnesium metabolism, ed. by B. E. C. Nordin, Edinburgh, 1976; Inborn errors of calcium and bone metabolism, ed. by H. Bickel a. J. Stern, Lancaster, 1976; The pharmacological basis of therapeutics, ed. by L. S. Goodman a. A. Gilman, L., 1975.
В. М. Боголюбов; Г. А. Аврунина (рад.), М. В. Комендантова (фарм.), С. П. Михайлова (мет. иссл.).
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Введение
Кальций -- широко распространенный химический элемент -- входит в состав почти всех природных и промышленных материалов. Содержание его в объектах колеблется в широких пределах: от основы в известняках, доломитах и силикатах до следовых количеств (высокочистые металлы). Поэтому аналитическая химия кальция решает вопросы как определения сравнительно больших количеств кальция в присутствии магния и других сопутствующих элементов (в этом случае примеси не сказываются, как правило, на точности получаемых результатов), так и определения следов кальция в различных материалах, где точность результатов зависит от природы основы и в большей степени от количественного содержания и природы других примесных элементов.
Несмотря на то, что методы определения кальция были предметом пристального внимания многих исследователей и по этому вопросу накоплена огромная библиография, включающая более шести тысяч источников, определение кальция часто представляет собой довольно сложную задачу. Следует особо подчеркнуть, что в последние годы в аналитической химии кальция достигнуты значительные успехи.
Проблема определения больших количеств кальция была успешно решена введением в аналитическую практику комплексонометрии. Не преувеличивая, можно сказать, что комплексонометрия произвела «революционный переворот» в аналитической химии кальция. Точность этого метода превосходит точность всех титриметрических методов определения кальция, а в ряде случаев -- и гравиметрических. Кроме того, исключительно важное значение имеет возможность селективного определения кальция на фоне больших количеств магния.
Следующий важный этап в развитии аналитической химии кальция -- разработка метода селективного экстракционного отделения этого элемента с органическим реагентом азо-азокси-БН. Этот метод пригоден для отделения сравнительно больших количеств кальция, но особенно важен для следовых. Экстракция азо-азокси-БН позволяет отделять кальций от других щелочноземельных элементов. Методы определения малых концентраций кальция базируются в основном на эмиссионном спектральном анализе и атомно-абсорбционной спектроскопии.
В связи с требованиями экспрессности анализа все большее значение при определении кальция приобретает рентгенофлуоресцентный метод.
В настоящей монографии рассматриваются почти все известные химические, физико-химические и физические методы определения кальция.
кальций гравиметрический титриметрический потенциометрический
1. Литературный обзор
1. Свойства и применение кальция
Химический элемент II группы периодической системы Менделеева, атомный номер 20, атомная масса 40,08; серебряно-белый легкий металл. Природный элемент представляет смесь шести стабильных изотопов: 40Ca, 42Ca, 43Ca, 44Ca, 46Ca и 48Ca, из которых наиболее распространен 40Ca (96, 97%).
Соединения Ca - известняк, мрамор, гипс (а также известь - продукт обжига известняка) уже в глубокой древности применялись в строительном деле. Вплоть до конца 18 века химики считали известь простым телом. В 1789 году А. Лавуазье предположил, что известь, магнезия, барит, глинозем и кремнезем - вещества сложные. В 1808 году Г. Дэви, подвергая электролизу с ртутным катодом смесь влажной гашеной извести с оксидом ртути, приготовил амальгаму Ca, а отогнав из нее ртуть, получил металл, названный "Кальций" (от лат. calx, род. падеж calcis - известь).
Способность кальция связывать кислород и азот позволила применить его для очистки инертных газов и как геттер (Геттер - вещество, служащее для поглощения газов и создания глубокого вакуума в электронных приборах.) в вакуумной радиоаппаратуре.
Кальций используют и в металлургии меди, никеля, специальных сталей и бронз; им связывают вредные примеси серы, фосфора, избыточного углерода. В тех же целях применяют сплавы кальция с кремнием, литием, натрием, бором, алюминием.
В промышленности кальций получают двумя способами:
1. Нагреванием брикетированной смеси СаО и порошка Аl при 1200 °С в вакууме 0,01 - 0,02 мм. рт. ст.; выделяющиеся по реакции:
СаО + 2Аl = 3CaO · Al2O3 + 3Ca
Пары кальция конденсируются на холодной поверхности.
2. Электролизом расплава СаСl2 и КСl с жидким медно-кальциевым катодом приготовляют сплав Сu - Ca (65% Ca), из которого кальций отгоняют при температуре 950 - 1000 °С в вакууме 0,1 - 0,001 мм.рт.ст.
3. Разработан также способ получения кальция термической диссоциацией карбида кальция СаС2.
Кальций весьма распространен в природе в форме различных соединений. В земной коре он занимает пятое место, составляя 3,25 %, и чаще всего встречается в виде известняка CaCO3, доломита CaCO3· Mg CO3, гипса CaSO4· 2H2O, фосфорита Ca3(PO4)2 и плавикового шпата CaF2, не считая значительной доли кальция в составе силикатных пород. В морской воде содержится в среднем 0,04% (вес.) кальция.
В данной курсовой работе изучены свойства и применение кальция, а так же подробно рассмотрена теория и технологии вакуум-термических способов его получения.
1.1 Физические свойства
Кальций - серебристо-белый металл, но на воздухе тускнеет из-за образования оксида на его поверхности. Это пластичный металл тверже свинца. Кристаллическая решетка формы Ca (устойчивой при обычной температуре) гранецентрированная кубическая, а = 5,56Е. Атомный радиус 1,97Е, ионный радиус Ca2+, 1,04Е. Плотность 1,54 г/см3(20 °C). Выше 464 °C устойчива гексагональная?-форма. tпл 851 °C, tкип 1482 °C; температурный коэффициент линейного расширения 22·10-6 (0-300 °C); теплопроводность при 20 °C 125,6 Вт/(м·К) или 0,3 кал/(см·сек·°C); удельная теплоемкость (0-100 °C) 623,9 дж/(кг·К) или 0,149 кал/(г·°C); удельное электросопротивление при 20 °C 4,6·10-8 ом·м или 4,6·10-6 ом·см; температурный коэффициент электросопротивления 4,57·10-3 (20 °C). Модуль упругости 26 Гн/м2 (2600 кгс/мм2); предел прочности при растяжении 60 Мн/м2 (6 кгс/мм2); предел упругости 4 Мн/м2 (0,4 кгс/мм2), предел текучести 38 Мн/м2 (3,8 кгс/мм2); относительное удлинение 50%; твердость по Бринеллю 200-300 Мн/м2 (20-30 кгс/мм2). Кальций достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием .
1.2 Химические свойства
Кальций - активный металл. Так при обычных условиях он легко взаимодействует с кислородом воздуха и галогенами
Са + О2 = 2 СаО (оксид кальция) (1)
Са + Вr2 = СаВr2 (бромид кальция). (2)
С водородом, азотом, серой, фосфором, углеродом и другими неметаллами кальций реагирует при нагревании:
Са + Н2 = СаН2 (гидрид кальция) (3)
Са + N2 = Са3N2 (нитрид кальция) (4)
Са + S = СаS (сульфид кальция) (5)
Са + 2 Р = Са3Р2 (фосфид кальция) (6)
Са + 2 С = СаС2 (карбид кальция) (7)
С холодной водой кальций взаимодействует медленно, а с горячей - очень энергично, давая сильное основание Са(ОН)2:
Са + 2 Н2О = Са(ОН)2 + Н2 (8)
Будучи энергичным восстановителем, кальций может отнимать кислород или галогены от оксидов и галогенидов менее активных металлов, т. е. обладает восстановительными свойствами:
Са + Nb2О5 = СаО + 2 Nb; (9)
Са + 2 NbСl5 = 5 СаСl2 + 2 Nb (10)
Кальций энергично взаимодействует с кислотами с выделением водорода, реагирует с галогенами, с сухим водородом с образованием гидрида СаН2. При нагревании Кальций с графитом образуется карбид СаС2. Кальций получают электролизом расплавленного CaCl2 или алюминотермическим восстановлением в вакууме:
6СаО + 2Al = 3Ca + 3CaO·Al2О3 (11)
Чистый металл используют для восстановления соединений Cs, Rb, Cr, V, Zr, Th, U до металлов, для раскисления сталей .
1.3 Применение
Кальций находит все возрастающее применение в различных отраслях производства. В последнее время он приобрел большое значение как восстановитель при получении ряда металлов.
Чистый металлический уран получается восстановлением металлическим кальцием фтористого урана. Кальцием или его гидридами можно восстанавливать окислы титана, а также окислы циркония, тория, тантала, ниобия, других редких металлов.
Кальций является хорошим раскислителем и дегазатором при получении меди, никеля, хромоникелевых сплавов, специальных сталей, никелевых и оловянистых бронз; он удаляет из металлов и сплавов серу, фосфор, углерод.
Кальций образует с висмутом тугоплавкие соединения, поэтому его применяют для очистки свинца от висмута.
Кальций добавляют в различные легкие сплавы. Он способствует улучшению поверхности слитков, мелкозернистости и понижению окисляемости.
Большое распространение имеют содержащие кальций подшипниковые сплавы. Свинцовые сплавы (0,04 % Са) могут применяться для изготовления оболочек кабеля .
В технике применяются антифрикционные сплавы Кальция со свинцом. Широко применяются минералы Кальция. Так, известняк используют в производстве извести, цемента, силикатного кирпича и непосредственно как строительный материал, в металлургии (флюс), в химической промышленности для производства карбида кальция, соды, едкого натра, хлорной извести, удобрений, в производстве сахара, стекла.
Практическое значение имеют мел, мрамор, исландский шпат, гипс, флуорит и др. . Благодаря способности связывать кислород и азот кальций или сплавы кальция с натрием и другими металлами применяют для очистки благородных газов и как геттер в вакуумной радиоаппаратуре. Кальций так же применяется для получения гидрида, который является источником водорода в полевых условиях .
1.4 Получение
Кальций впервые получен Дэви в 1808 г. с помощью электролиза. Но, как и другие щелочные и щелочноземельные металлы, элемент №20 нельзя получить электролизом из водных растворов. Кальций получают при электролизе его расплавленных солей.
Это сложный и энергоемкий процесс. В электролизере расплавляют хлорид кальция с добавками других солей (они нужны для того, чтобы снизить температуру плавления СаСl2).
Стальной катод только касается поверхности электролита; выделяющийся кальций прилипает и застывает на нем. По мере выделения кальция катод постепенно поднимают и в конечном счете получают кальциевую «штангу» длиной 50...60 см. Тогда ее вынимают, отбивают от стального катода и начинают процесс сначала. «Методом касания» получают кальций сильно загрязненный хлористым кальцием, железом, алюминием, натрием. Очищают его переплавкой в атмосфере аргона.
Если стальной катод заменить катодом из металла, способного сплавляться с кальцием, то при электролизе будет получаться соответствующий сплав. В зависимости от назначения его можно использовать как сплав, либо отгонкой в вакууме получить чистый кальций. Так получают сплавы кальция с цинком, свинцом и медью.
В промышленности кальций можно получить с помощью электролиза расплавленного хлорида кальция CaCl2.
CaCl2 = Ca + Cl2
В этом процессе ванна, сделанная их графита, является анодом. Ванна помещается в электрическую печь. Железный стержень, перемещающийся по ширине ванны, а также имеющий возможность подниматься и опускаться, является катодом. Электролитом является расплавленный хлористый кальций, который заливают в ванну. В электролит опускается катод. Так начинается процесс электролиза. Под катодом образуется расплавленный кальций. Когда катод поднимается, в месте касания с катодом кальций застывает. Так постепенно в процессе поднятия катода и происходит наращивание кальция в виде штанги. Затем кальциевую штангу отбивают от катода.
Впервые чистый кальций с помощью электролиза был получен в 1808 г.
Кальций также получают из оксидов с помощью алюминотермического восстановления.
4CaO + 2Al -> CaAl2O4 + Ca
При этом кальций получается в виде пара. Затем этот пар конденсируется.
Кальций имеет высокую химическую активность. Именно поэтому он широко используется в промышленности для восстановления тугоплавких металлов из оксидов, а также в производстве стали и чугуна.
2. Методы определения ионов кальция
2.1 Гравиметрические методы.
При гравиметрическом определении кальция чаще всего применяются органические осадители и особенно оксалаты. В некоторых случаях используются и неорганические осадители, в частности, серная кислота и ее соли.
Осаждение в виде оксалата. Наиболее распространенным методом осаждения кальция служит оксалатный, позволяющий получать точные результаты при относительно простых условиях 1807, 898, 1645]. Метод основан на выделении кальция в виде труднорастворимого осадка оксалата СаС204"Н20 (ПР = 2,6-10"9). Известны три гидрата оксалата кальция: СаС204-Н20, СаС204-*2 Н20 и СаС204-ЗН20. При обычных условиях стабильная форма -- моногидрат (получается при осаждении из горячих растворов). Ди- и тригидраты, образующиеся при осаждении в холодном растворе, переходят при стоянии в моногидрат (быстрее -- при нагревании ).
В качестве осадителя часто используют щавелевую кислоту Н2С204 . Некоторые исследователи отдают предпочтение оксалатам натрия и калия . Однако удобнее пользоваться оксалатом аммония , включенным в рациональный ассортимент органических реагентов для осаждения и гравиметрического определения кальция. Для осаждения используют избыток насыщенного раствора оксалата аммония .
При осаждении оксалата кальция применяли метил-, диметил-или диэтилоксалат . В этих случаях образуются более крупные кристаллы.
Оксалат кальция СаС204-Н20 осаждают из кислых и щелочных растворов ; известны методы осаждения из кислых растворов, которые затем нейтрализуют аммиаком до определенного значения рН .
Осаждение оксалата кальция из кислых и щелочных растворов; неэффективно, так как получается мелкозернистый осадок, который трудно отфильтровать и промыть; такой осадок адсорбирует примеси, особенно в присутствии магния . В кислой среде происходит частичное растворение СаС204, в щелочной -- соосаждение Са(ОН)2 и образование СаС03 за счет поглощения аммиаком С02 из воздуха.
Чистые, крупнокристаллические осадки постоянного состава получаются при осаждении СаС204 из кислых растворов с последующей нейтрализацией аммиаком. Чаще всего оксалат кальция осаждают из солянокислой среды . Крупнокристаллические осадки получают и при осаждении оксалата кальция в уксуснокислой среде .
К анализируемому раствору, содержащему кальций, добавляют в присутствии соответствующего индикатора соляную кислоту до кислой реакции, раствор нагревают и приливают избыток горячего насыщенного раствора оксалата аммония. Горячий раствор медленно нейтрализуют аммиаком до перехода окраски индикатора. Благодаря медленной нейтрализации в растворе почти до конца осаждения сохраняется кислая среда, что способствует получению крупных кристаллов с минимальным количеством примесей.
При осаждении оксалата кальция из холодных растворов образуются кристаллические трудно фильтрующиеся осадки . Кипячение способствует переходу в осадок вместе с кальцием и магния, если он присутствует в растворе. Наиболее удобно осаждать оксалат кальция при 60--80° С путем прибавления горячего раствора оксалата аммония к подогретому кислому, раствору, содержащему кальций.
Растворимость оксалата кальция возрастает с увеличением концентрации ионов водорода в растворе, так как присутствие ионов Н50+ приводит к удалению оксалат-ионов из равновесной системы.
Оксалат кальция осаждается количественно при рН 4 [ 272] (практически не ниже 4 и не выше 6) , поэтому индикатором при осаждении СаС204 служит метиловый красный (рН) перехода окраски 4,4-0,2) . Г Обычно пользуются не спиртовым, а водным раствором метилового I красного. Опыты показали, что при осаждении оксалата кальция в присутствии капли спиртового раствора индикатора получаются завышенные результаты на 2% и более . Это связано с тем, что последний захватывается осадком СаСг04, не отмывается итатру-ется перманганатом. Довольно часто используют метиловый оранжевый или бромкрезоловый зеленый .
2.2 Титриметрические методы
Для титриметрического определения кальция наиболее часто используется комплексонометрия.
Комплексонометрическое титрование
С ионами кальция комплексон III образует прочное, растворимое в воде, бесцветное соединение состава 1: 1. Для комплексонв-та кальция рК = 10,96 . Комплексонометрическое титрование кальция проводят в щелочной среде. При рН 10 определяют сумму кальция и магния, при рН 12,5 -- кальций в присутствии магния.
Приводятся обзоры комплексонометрических методов определения кальция и магния и индикаторов, применяемых для этих целей .
Шварценбах и Бидерман предложили определять сумму кальция и магния комплексонометрически с индикатором эриохром черным Т (хромоген черный ЕТ-00, солохром черный Т, ализарин черный Т), представляющим собой натриевую соль (1-окси-2-нафтилазо)-6"-нитро-2"-нафтол-4"-сульфокислоты.
При рН 6 эриохром черный Т окрашен в вишто-красный цвет. При более высоком значении рН окраска переходит в синюю и при рН 12 становится желто-оранжевой (рКг = 6,3; рйГ2 = = 11,5).
С магнием и кальцием эриохром черный Т образует комплексные соединения с отношением катиопа к лиганду 1: 1 .
Чувствительность взаимодействия эриохром черного Т с кальцием (1,4-10~б г Са1мл) значительно меньше, чем с магнием (8,4-Ю-8 г Mg/лм) .
К раствору, содержащему магний и кальций, прибавляют воду до объема 100 мл, 5 мл аммиачного буферного раствора (рН 10--11) (20 мг NH4C1 растворяют в воде, прибавляют 100 мл 25%-ного раствора NH4OH и разбавляют до 1 л водой), 4--5 капель индикатора (0,5 г индикатора растворяют в 20 мл аммиачного буферного раствора и разбавляют до 100 мл этанолом) и титруют 0,01 М раствором комплексона Ш до перехода винно-красной окраски в синюю.
При определении кальция в отсутствие магния или при низких его содержаниях не наблюдается четкого перехода окрасок эриохром черного Т ;
РЬ амальгама/РЬС204-СаСа04/Са2+ вариантах. Если суспензию получают с концентрированными растворами реагента в присутствии спирта, результаты более воспроизводимы. Увеличивает чувствительность определения присутствие аммиака; соли и кислоты понижают ее . Для стабилизации суспензии добавляют защитный коллоид .При анализе биологических объектов (кровь, моча) применяют нефелометрический метод определения кальция с олеатным реактивом .
Определение кальция в сыворотке крови олеатным методом выполняется следующим образом .
К 0,5 мг сыворотки прибавляют 1 мл воды и 0,5 мл 20%-ного раствора трихлоруксусной кислоты. Через 5 мин. осадок центрифугируют. 1,3 мл центрифугата помещают в колориметрическую кювету, прибавляют 0,2 мл конц. NH4OH и 1 мл олеатного реагента. Через 15 мин. определяют кальций турбидиметрически при 420 нм.
Описаны нефелометрические и турбидиметрические методы определения кальция со стеариновой кислотой , сульфорицинатом или сульфоорцинолеатом натрия . Последний реагент позволяет определять кальций в присутствии магния (на фоне ионов аммония магний не осаждается сульфоорцинолеатом).
Кальций можно определять, нефелометрируя суспензию сульфата кальция. Предложен следующий метод определения кальция в почвах .
2,5 г воздушно-сухой почвы встряхивают 30 сек. при 25--35° С с 25 мл раствора экстрагепта (0,05iV HaS04, содержащая 0,35 г бората/л, рН 1,6) и фильтруют. Раствор нейтрализуют по бриллиантовому желтому 10%-ным раствором NaOH и подкисляют 5 N СН3СООН. К 2 мл этого раствора в колориметрической пробирке прибавляют 2 мл этилового спирта, высаливающего CaS04, встряхивают и через 5 мин. сравнивают со стандартами, приготовленными из сульфата кальция аналогичной обработкой.
Описано нефелометрическое определение кальция с н а ф т и л-гидроксаматом натрия и хлораниловой кислотой .
2.7 Флуориметрические методы
Количественное флуориметрическое определение кальция применяется сравнительно редко. Чаще всего используют метод, основанный на взаимодействии ионов кальция с флуорексо-ном (кальцеином) с образованием флуоресцирующего комплекса. Флуорексон в щелочном растворе не флуоресцирует. Максимум флуоресценции наблюдается при 517 нм . Для установления соответствующего значения рН используют 0,liV раствор КОН. В присутствии едкого натра или аммиака наблюдается довольно значительная флуоресценция холостого опыта. Мешают А1, Ва, Си, Sr, Zn, Mn, Fe, которые дают такую же желто-зеленую флуоресценцию, как и кальций. AI, Fe и Мп можно замаскировать триэтаноламином; Са, Со, Си и Zn -- цианидами.Чувствительность реакции 0,08 мкг Са/1 мл раствора .Флуоресцентное определение кальция с флуорексоном используют при анализе биологических объектов .
Описано флуоресцентное определение кальция с флуорексоном в полиэтилене низкого давления .
8-0 ксихинолилгидразон 8-хинальдинового альдегида отличается высокой чувствительностью и избирательностью при определении кальция. Возникающая зеленая флуоресценция развивается 10--15 мин. Реакцию проводят в 0,1 М растворе КОН. Чувствительность определения с учетом критерия Зо" составляет 0,02 мкг Са/5 мл раствора. Не мешают определению щелочные металлы, 10-кратные количества стронция, 100-кратные количества Mg, Ва, равные количества РЬ, Fe, Mn, Си, In, Cd, Zn; 10-кратные количества Со, Fe, Та, 100-кратные количества Be, Сг; 1000-кратные W, Bi, Pt и Ni гасят флуоресценцию. В присутствии 200 мкг Mg/5 мл 0,lN раствора КОН появляется красная люминесценция, которая мешает определению кальция в окиси магния . Для удержания магния в растворе добавляют хлорид аммония.
8-Оксихинолилгидразон 8-хинальдинового альдегида применен при определении кальция, в метилтрихлорсилане (5* 10~8%) , в хлориде цезия , в воде и этиловом спирте (10~"%) .
Определение кальция в воде и этиловом спирте выполняют следующим образом.
В двух кварцевых чашках выпаривают по 100 мл воды (128 мл спирта), предварительно добавив в одну из них 0,15 мкг Са. Остаток из каждой чашки смывают 5 мл 0,1 N раствора КОН (2--3 порции)[и переносят в пробирки. Одновременно в третью пробирку наливают 5 мл 0,1 N раствора КОН (контрольный опыт). Во все три пробирки приливают по 0,2 мл 5-Ю-4 М раствора реагента и через 10--15 мин. Измеряют интенсивность флуоресценции на флуориметре ФО-1 с низковольтной лампой накаливания мощностью 20 вт и фотоумножителем ФЭУ-38 с использованием светофильтров; первичных СЗС-21 (3) + СС-5 (а), вторичных ИСС-4 (3) + ОС-11 (3).
2. Экспериментальная часть
Качественный анализ.
Реакции ионов кальция
1. Оксалат аммония образует с ионами кальция кристаллический осадок СаС2О4 · Н2О: Осадок растворим в сильных кислотах, но нерастворим в уксусной кислоте: Предел обнаружения кальция -- 20 мкг. Мешают ионы Ва2+ и Sr2+, дающие с (NH4)2C2O4 аналогичные осадки. Отличительной особенностью осадков ВаС2О4 и SrC2O4 является их растворимость в уксусной кислоте:
2ВаC2O4 + 2СН3COOН = Ва(НC2O4)2 + Ва(СН3COO)2. (22)
Выполнение реакции.
К 2--3 каплям раствора, содержащего ионы кальция, добавляют 2--3 капли раствора реагента. Выпадает белый кристаллический осадок.
Определение кальция методом стандартных добавок.
Экспериментальная часть.
Приборы и реактивы: Пламенный фотометр ФПЛ, ПАЖ, ПФМ и др. Компрессор. Источник возбуждения: пламя светильный газ-воздух. Раствор соли кальция с концентрацией кальция 100 мкг/мл.
Навеску СаСО3 (хч) 0,0250 г (F= MCaCO3/ACa = 2,500) растворяют в стакане в небольшом объеме 2М НСl, переносят раствор в мерную колбу вместимостью 100 мл, доводят до метки дистиллированной водой и тщательно перемешивают.
Выполнение работы.
Пробу анализируемой воды разбавляют дистиллированной водой так, чтобы она содержала примерно 1000 мкг кальция в 10 мл. В три мерные колбы вместимостью 100 мл переносят по 10 мл разбавленной анализируемой воды и добавляют во вторую и третью колбы соответственно 10 и 20 мл раствора соли кальция. Доводят объемы растворов в колбах до меток дистиллированной водой и тщательно перемешивают. Фотометрируют полученные растворы, как указано выше, и записывают результаты в виде таблицы: Номер раствора Объем разбавленной анализируемой воды, мл Объем раствора добавки, мл Концентрация добавки в пробе, мкг/мл Отсчет, мкА 1 10,00 - - 2 10,00 10,00 10,00 3 10,00 20,00 10,00 Определяют неизвестную концентрацию Сх графическим или расчетным методом и находят концентрацию кальция С (в мкг/мл) в питьевой воде по формуле: где VM -- вместимость мерной колбы; VP -- объем аликвотной части анализируемой воды (вода после разбавления); n -- степень разбавления питьевой воды. Если график зависимости аналитического сигнала I от С непрямолинеен, то применяют логарифмический вариант метода.
Размещено на Allbest.ru
...Подобные документы
Исследование физических и химических свойств кальция. Электролитическое и термическое получение кальция и его сплавов. Алюминотермический способ восстановления кальция. Влияние температуры на изменение равновесной упругости паров кальция в системах.
курсовая работа , добавлен 23.10.2013
Химические свойства кальция. Применение чистого карбоната кальция в оптике, известняка в металлургии - в качестве флюсов. Гипс как кристаллогидрат сульфата кальция. Кальциевая соль ортофосфорной кислоты как основной компонент фосфоритов и апатитов.
реферат , добавлен 23.01.2010
Хлорид кальция: физико-химические свойства. применение и сырье. Получение плавленого хлорида кальция из дистиллерной жидкости содового производства. Получение хлорида кальция и гидроксилохлорида из маточного щелока. Безводный кальций из соляной кислоты.
реферат , добавлен 09.08.2008
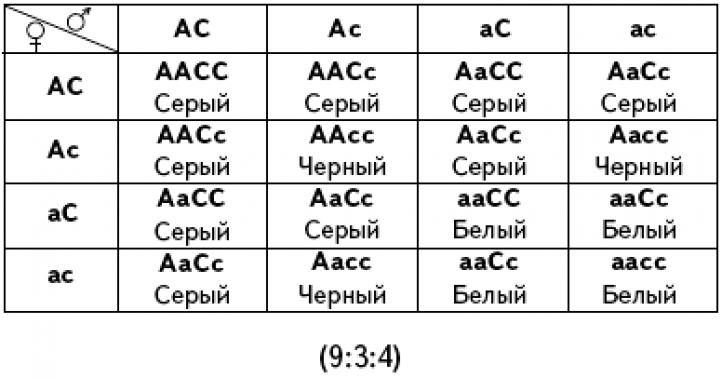
Соединения магния, кальция и бария как лекарственные средства. Изменения в группе величины радиусов атомов и ионов, потенциал ионизации. Качественные реакции на ионы магния, кальция, стронция. Биологическая роль магния и кальция, значение для организма.
реферат , добавлен 14.04.2015
Кристаллическая структура гидроксилапатита. Описание методов синтеза фосфатов кальция. Рентгеновский фазовый анализ для определения фазового состава образца. Экспериментальное проведение синтеза фосфата кальция методом осаждения из водных растворов.
курсовая работа , добавлен 10.09.2012
Расчет концентрации нитрата кальция в водном растворе для его применения в составе охлаждающей жидкости. Определение зависимости показателя преломления фаз системы вода-нитрат кальция при отрицательной температуре от концентрации методом рефрактометрии.
курсовая работа , добавлен 12.12.2012
Элементы и их соединения в современной неорганической химии. Синтез сульфата кальция, его химические свойства. Проведение качественного анализа на ионы. Расчёт исходных реагентов и определение условий проведения синтеза, выбор приборов и оборудования.
курсовая работа , добавлен 12.12.2009
История и происхождение названия, нахождение в природе, получение кальция, его физические и химические свойства. Применение металлического кальция и его соединений. Биологическая роль и потребность организма в кальции, его содержание в продуктах питания.
реферат , добавлен 27.10.2009
Массовое производство и использование карбоната кальция - неорганического химического соединения, соли угольной кислоты и кальция. Полиморфные модификации карбоната кальция. Фазовая диаграмма кальцита, арагонита и фатерита при разных температурах.
реферат , добавлен 25.11.2015
Элемент главной подгруппы второй группы, четвертого периода периодической системы химических элементов Д. И. Менделеева. История и происхождение названия. Нахождение кальция в природе. Физические и химические свойства. Применение металлического кальция.
Методы количественного определения кальция. Существуют различные методы определения кальция.
а) Весовые методы.
1) Осаждение в виде оксалата и взвешивание в виде или (см. «Весовой анализ»).
2) Осаждение в виде сульфата из спиртового раствора.
3) Осаждение в виде пикролоната .
б) Объемные методы.
1) Осаждение в виде оксалата кальция и последующее определение связанного с кальцием оксалат-иона методом перманганатометрии или цериметрии.
2) Осаждение в виде молибдата , восстановление молибдена и титрование его ванадатом аммония.
3) Комплексонометрический метод.
Весовой метод определения кальция имеет весьма существенные недостатки.
1. Определение содержания кальция в различных технических объектах весовым методом представляет собой весьма длительную операцию.
2. Осаждение ионов кальция в виде связано с большими трудностями, обусловливаемыми невозможностью достижения количественного выделения оксалата кальция;
3. Осадок оксалата кальция бывает часто загрязнен посторонними примесями и его трудно выделить в химически чистом виде.
4. Получение весовой формы связано с применением относительно высокой температуры, необходимой для термического разложения оксалата кальция.
5. Получаемая весовая форма нестабильна и подвергается действию влаги и двуокиси углерода воздуха, вследствие чего ее масса меняется в зависимости от условий получения, и хранения.
Поэтому в настоящее время весовой метод определения кальция утратил прежнее свое значение и вытеснен более прогрессивными объемными методами анализа.
Один из этих методов описан выше (см. гл. II.I, § 28). Перманганатометрический метод определения кальция отличается рядом преимуществ по сравнению с весовыми методами анализа. Одним из таких преимуществ является более быстрое завершение операции определения. Однако перманганатометрическому методу определения кальция, основанному на осаждении ионов кальция в виде оксалата и последующем титровании оксалат-ионов перманганатом, свойственны многие недостатки весового анализа, связанные с невозможностью полного количественного осаждения и отделения оксалата кальция.
Из объемных методов анализа наиболее точным и быстрым методом определения кальция несомненно является комплексонометрическое титрование ионов кальция комплексоном III.
Комплексонометрический метод определения кальция. Комплексонометрическое определение кальция основано на прямом методе титрования его ионов стандартным раствором комплексона III в присутствии мурексида или кислотного хром темно-синего. Индикатор образует с ионами кальция комплексное соединение красного цвета. При титровании раствора комплексоном III в точке эквивалентности красная окраска переходит в окраску, характерную для свободного индикатора.
В результате титрования солей кальция комплексоном III происходит образование комплекса и кислоты:
Образующийся комплекс относительно неустойчив:
![]()
Поэтому образование свободной кислоты во время реакции или прибавление ее в титруемый раствор перед титрованием сдвигает указанное равновесие влево, т. е. в сторону разрушения комплекса.
ЭДТА является четырехосновной кислотой, характеризуется следующими константами: и представляет собой относительно слабую кислоту, поэтому раствора ее комплекса с не должен быть ниже 10,3. Если будет меньше, то образует соответствующие гидроанионы: и кислоту . При этом комплекс разрушается или не образуется совсем.
Таким образом, устойчивость внутрикомплексной соли, образуемой ионами кальция с комплексоном III зависит от величины раствора.
Поэтому для обеспечения оптимального течения реакции образования комплекса - титрование солей кальция раствором ЭДТА нужно проводить в сильнощелочной среде при . В этом случае достигается полная нейтрализация образующейся в процессе Нитрования свободной кислоты и наблюдается максимальный скачок кривой титрования (рис. 61).

Рис. 61. Кривые титрования иоков кальция комплексоно-метрическим методом при различных значениях раствора: 1 - ; 2 - ; 3 - ; 4 - .
1. Комплексонометрический метод . Вариант прямого титрования. Метод основан на свойстве ионов магния количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных, растворимых в воде, бесцветных внутрикомплексных соединений.
Титрант: раствор трилона Б – динатриевая соль этилендиаминотетрауксусной кислоты (сокращенно – Na 2 H 2 ТrБ).
Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом. Изменение окраски металлоиндикаторов зависит от pH среды.
Определение солей магния проводят в среде аммиачного буфера при рН 9,5-10,0. Индикатор – кислотный хром черный специальный (эриохром черный Т). Переход окраски от красно-фиолетовой к синей.
Магния оксид предварительно растворяют в кислоте хлороводородной разведенной.
Mg 2+ + H 2 Ind MgInd + 2H +
Окраска раствора за счет
комплекса металла с индикатором
В точке эквивалентности:
MgInd + Na 2 H 2 ТrБ MgNa 2 ТrБ + H 2 Ind
Окраска раствора за счет
свободного индикатора
f экв (ЛВ) = 1
2. Ацидиметрический метод нейтрализации (вариант обратного титрования). Используется для количественного определения магния оксида. Метод основан на свойстве магния оксида количественно взаимодействовать с кислотой хлороводородной с образованием соли:
MgO + 2HCI → MgCI 2 + 2H 2 O
HCI + NaOH → NaCI + H 2 O
f экв (магния оксида) = Ѕ
Хранение
По общему списку, в хорошо укупоренной таре. Магния сульфат при нарушении условий хранения постепенно теряет кристаллизационную воду (выветривается); магния оксид взаимодействует с углекислым газом и влагой, содержащимися в воздухе, образуя примесь карбоната и магния гидроксида:
MgO + CO 2 → MgCO 3
MgO + H 2 O → Mg(OH) 2
Применение
Магния оксид – антацидное средство с легким послабляющим эффектом.
Магния сульфат – спазмолитическое, противосудорожное, успокаивающее, желчегонное и слабительное средство.
СОЕДИНЕНИЯ КАЛЬЦИЯ
Получение
Кальция хлорид получают из природного минерала – кальцита:
CaCO 3 + 2HCI → CaCI 2 + CO 2 + H 2 O
Сопутствующие примеси (соли железа и магния) осаждают раствором кальция гидроксида:
2FeCI 3 + 3Ca(OH) 2 → 2Fe(OH) 3 ↓ + 3CaCI 2
MgСI 2 + Ca(ОН) 2 → Mg(ОН) 2 ↓ + СаСI 2
Осадки железа и магния гидроксидов отфильтровывают.
Магний и кальций являются основными или побочными составными частями многочисленных природных или искусственных продуктов. Классические методы анализа этих двух катионов требуют больших затрат «времени, тогда как комплексонометрическое титрование предоставляет исследователю возможность изящного определения обоих металлов, что сильно способствовало быстрому внедрению этого метода в аналитическую практику.
Нам кажется целесообразным обсуждать одновременно оба металла, так как почти всегда они присутствуют вместе, и поэтому важно знать поведение смеси Са и Mg, даже если требуется определить лишь один из этих элементов.
Анализ биологических жидкостей, благодаря его большому практическому значению, рассматривается в отдельном разделе. Приведенные литературные ссылки представляют собой лишь часть всех относящихся к данной теме публикаций, что кажется нам совершенно справедливым, так как большинство работ, с точки зрения собственно комплексонометрического титрования, не содержит ничего нового.
Цитируемые работы все же дают полное представление о существующих возможностях метода и об еще не разрешенных проблемах.
Определение Mg с помощью ЭДТА было уже давно описано Шварценбахом с сотр. . Примененный ими индикатор эриохром черный Т является одним из наиболее часто применяемых в настоящее время. Выполнение титрования в микромасштабе и даже определение микрограммовых количеств не вызывает затруднений. Были обстоятельно изучены вопросы точности комплексонометрических определений и стехиометрии титрования .
Устойчивость комплексов ЭДТА и индикатора с Mg довольно высока, чтобы можно было проводить титрование с достаточной точностью; изменение окраски в точке эквивалентности (из винно-красной в синюю) несколько менее четкое, чем при других комплексонометрических титрованиях. Следует титровать до полного исчезновения красного оттенка, распознать которое, однако, нетрудно. Реакция в точке эквивалентности протекает несколько замедленно, поэтому раствор следует немного подогревать.
Эриохром черный Т и многие аналогичные красители блокируются следами тяжелых металлов, прежде всего меди, которые, однако, нетрудно удалить, применяя соответствующие маскирующие вещества. Цианид калия устраняет помехи со стороны Си, Ni, Со, Fe и т. д. Такую же функцию выполняют Na2S (при этом примеси тяжелых металлов осаждаются в виде сульфидов) и Мn - титровании Mg в присутствии большого количества Mn см. . Алюминий можно замаскировать с помощью триэтанол-амина, причем следует проводить титрование при 5° С , так как в противном случае возможен переход Al из комплекса с маскирующим веществом в комплекс с индикатором.
Помехи, вызванные присутствием следов тяжелых металлов, часто можно устранить путем использования метода обратного титрования. При этом мешающие примеси связываются в комплекс с ЭДТА и реагируют с индикатором лишь медленно или совсем не реагируют; таким образом, обратное титрование может быть за-, кончено до того, как наступит блокирование индикатора. Если, например, проводят обратное титрование раствором Zn, то содержание Си до 20 мг в литре раствора не оказывает вредного влияния. На том же принципе построен предложенный Ганом метод защитного титрования, основанный на относительном, отсутствии помех и заключающийся в том, что известное количество титрованного раствора ЭДТА титруют анализируемым раствором.
Кроме эриохрома черного Т, применяют большое число других индикаторов, например алюминон , позволяющий проводить последовательное титрование смеси Fe-Аl-Са-Mg, лаковый алый С , красители ряда кислотного хрома синего , хромоксан зеленый , пирокатехиновый фиолетовый , арсеназо I . Дил и др., с одной стороны , и группа исследователей во главе с Белчером, с другой , исследовали большое число красителей с точки зрения их пригодности в качестве индикаторов. В последнее время большим успехом пользуется калмагит ; по устойчивости комплексов с металлами и по изменению окраски он практически идентичен эриохрому черному Т, но его раствор более устойчив.
Индикация конечной точки титрования с помощью инструментальных методов включает преимущественно фотометрическое титрование, которое выполняют либо с самоиндикацией в УФ-области , либо с эриохромом черным Т , либо с другими индикаторами, например с хромазуролом S или калмагитом . При определении Mg и при последовательном титровании смесей Ni-Mg, Zn-Mg или Bi-Mg применяют также потенциометрическое титрование с ртутным катодом или амперометрическое титрование . Ниже -будут описаны также кондуктометрические и термометрические определения.
Мешающее влияние Mg на титрование других металлов проявляется только в щелочной среде, так что его присутствие едва ли составляет проблему при определении других металлов с тех пор, как стало возможным проводить титрование в кислом растворе. Маскировать Mg можно осаждением его в виде гидроокиси в сильнощелочном растворе (едкий натр) или с помощью фторид-ионов .
Титрованием Mg в присутствии фосфат-ионов занимался Колье , который советует удалять большие количества этих ионов экстракцией. Иониты также являются хорошим средством для удаления фосфат-ионов. Часто бывает достаточно сильного разбавления анализируемого раствора, для того чтобы замедлить образование MgNFLjPO.}, так как это соединение легко образует пересыщенные растворы. Кроме того, определять Mg в присутствии фосфат-ионов можно путем обратного титрования. О титровании Mg в присутствии Са будет сказано ниже. Здесь же можно отметить возможность отделения Са в виде молибдата и титрования Mg в фильтрате, если требуется определение одного только Mg-.
Магний можно определять комплексонометрически в фармацевтических препаратах , в алюминиевых сплавах , в сплаве электрон , в чугуне и литейном чугуне , в титане , сульфате никеля ,порохах , в почве и растительных материалах , горных породах и урановых шлаках .
Кальций является одним из первых металлов, для которых был описан метод комплексонометрического титрования . Титрование можно проводить в сильно разбавленных растворах, а также при наличии малых количеств Са . Применяемый при этом индикатор мурексид был подробно изучен , и его часто употребляют в настоящее время. В сильнощелочной среде (рН=12) происходит изменение красной окраски мурексида в сине-фиолетовую, не столь резкое, как у многих других металлохромных индикаторов. Раствор мурексида устойчив в течение лишь нескольких часов, поэтому индикатор целесообразно вносить в твердом виде, растертым с 100 частями NaCl. Следует учитывать также окислительное или гидролитическое разложение мурексида в анализируемом растворе, в особенности при фотометрических титрованиях, когда разложение иногда становится заметным благодаря медленному уменьшению светопоглощения. Для улучшения распознаваемости точки эквивалентности были предложены смешанные и ндикаторы, например 0,2 г мурексида с 0,5 г нафтолового зеленого В, хорошо перемешанные с 100 г NaCl .
В качестве индикаторов на Са было предложено много других веществ, которые, однако, не всегда превосходят мурексид. Приводим некоторые из них: калькой , CAL-Red ,эриохром сине-черный SE (Эрио SE) , кислотный хром сине-черный и другие . Все эти вещества являются о, о"-азосоединениями, сходными с эриохромом черным Т.
Систематическое исследование индикаторных свойств таких веществ принадлежит Дилу и сотр. . Многочисленные соединения были изучены также Белчером и сотр. . Позднее в качестве индикаторов на Са были испытаны: лаковый алый С , омега хром сине-зеленый BL , фтклеинкомплек-сон , глиоксаль-бис-(2-оксианил) , хромазу-рол S , Н-кислота , кислотный ализариновый черный SN и пирогаллолкарбоновая кислота . С алюминоном возможно последовательное титрование смеси Fe-Al-Са-Mg.
Упоминаемый ниже синтезированный Вестом кальцихром идентичен, по-видимому, гидрону, предложенному русскими авторами . Для определения Са пригодны также метилтимоловый синий и пирокатехиновый фиолетовый .
Кальцеин можно применять и как цветной , и как флуоресцентный индикатор (УФ-лучи). Флуоресце-инкомплексон за точкой эквивалентности имеет вызванную загрязнениями остаточную флуоресценцию , которая перекрывается при добавлении фенолфталеина (0,25 г фенолфталеина на 1 г индикатора) . Аналогично обстоит дело с кальцеином (кальцеином W), для перекрывания остаточной флуоресценции которого был предложен акридин . Тимолфталексон тоже рекомендуется в качестве флуоресцентного индикатора на Са. Чтобы обеспечить распознавание точки эквивалентости без помех, Тофт с сотр. предложили простой прибор, который оправдал себя при титровании с кальцеином, а также сослужил хорошую службу при титровании с другими флуоресцентными индикаторами.
Практически все индикаторы на Са дают резкий переход окраски только при высоком значении рН раствора. Однако существуют некоторые индицирующие системы, функционирующие при рН<11, например комплекс Mg с ЭДТА (его дббавляют по меньшей мере в количестве 5% от содержания присутствующего Са) или ZnY в комбинации с эриохромом черным Т, а также комбинации ZnY с цинконом и CuY с ПАН . При этом одновременно титруется присутствующий в растворе Mg.
Обычно предпочитают индикаторы, действующие при высоких значениях рН, так как магний, часто сопутствующий кальцию, при этом выпадает в осадок в виде гидроокиси (см. ниже). Следует учесть, что используемая для подщелачивания щелочь не должна содержать карбонатов, а также не должна поглощать их из воздуха, воды или других реактивов, так как в противном случае выпадает осадок СаСО3. Осадок снова растворяется в течение титрования, если проводить его медленно.
Однако выгоднее и экономичнее по времени избегать образования осадка, для чего удаляют карбонат-ионы и титруют в довольно разбавленных растворах с целью предотвращения возможного выпадения в осадок Са(ОН)г. Избежать образования мути можно также при применении метода обратного титрования.
Факторы, мешающие титрованию кальция, были подробно изучены. Присутствующие в большинстве природных и искусственных продуктов Fe и Аl могут быть выделены с помощью разнообразных способов. Отделение путем осаждения раствором аммиака возможно всегда, но часто оно отнимает много времени, так как может оказаться необходимым двойное осаждение. О маскировании Fe, Al и Мn можно прочитать в разделах, касающихся определения соответствующих элементов.
Если в растворе присутствует только Al, то для определения Са нет необходимости что-либо предпринимать, так как при обычных титрованиях при высоком рН Аl присутствует в виде алюминат-ионов, которые не реагируют с комплексо-ном. Однако следует обращать внимание на выбор-индикатора, так как некоторые красители в указанных условиях блокируются алюминием. В случае очень высокого содержания Al следует обратиться к ссылкам , а в случае высоких концентраций Mn - к ссылке .
Титан можно замаскировать перекисью водорода (см. определение титана). Широкие возможности для маскирования открывает применение цианида калия и ионитов. Следует принимать во внимание также возможность помех со стороны анионов. О помехах, создаваемых гидроксил- и карбонат-ионами, уже говорилось. Гексацианоферрат (II)-ион, присутствовавший в растворе сначала или же образовавшийся при маскировании Fe, может образовать муть вследствие малой растворимости его кальциевой соли; муть снова исчезает в процессе титрования. Особенно обстоятельно были изучены помехи, связанные с присутствием фосфат-ионов. Небольшие количества последних не мешают титрованию Са. Предельно допустимое соотношение Р: Са = 4: 1 , но оно сильно зависит от разбавления раствора.
Большие количества РО4-ионов не помешают определению, если прибегнуть к методу обратного титрования. Циммерман предлагает для определения Са в присутствии фосфат-ионов титрованный раствор, 0,1 М по ЭДТА и 0,05 М по ZnY. В крайнем случае, при исключительно высоком содержании фосфат-ионов, их отделяют методом ионного обмена или экстракцией .
Со времени применения титрования в кислой среде Са уже не является сильной помехой при определении других металлов. При некоторых титрованиях в щелочной среде (но не при титровании Mg) Са можно замаскировать с помощью фторид-ионов .
Точность и воспризводимость комплексонометрических определений Са хорошая, что подтверждается многочисленными исследованиями, например .
Существует много инструментальных методов определения Са. Чаще всего предпочитают фотометрическое титрование, так как невооруженным глазом трудно распознать переход окраски мурексида . Применяют и другие индикаторы, например калькой , CuY - ПАН , металлфталеин .
Фотометрическое титрование можно проводить с самоиндикацией в УФ-обла-сти (228 нм) ; его можно автоматизировать при использовании различных индикаторов . Описана индикация точки эквивалентности по наклону кривой титрования при добавлении Си2+-ионов . Амперометрическая индикация с ртутным капельным электродом дает возможность проводить последовательное титрование таких смесей, как, например, Ni-Са или Сu-Zn-Са, причем для индикации используют «волну комплексона». В сильноаммиачном растворе Са можно определять косвенным амперометрическим методом: из комплексоната цинка Са2+-ионы вытесяcняют Zn2+-, которые затем оттитровывают .
При потенниометрическом титровании с ртутной каплей в качестве электрода целесообразно пользоваться раствором ГЭДТА, так как при этом не мешает Mg . Газлам с сотр. проводят потенциометрическое автоматическое титрование с серебряным электродом; этим методом можно последовательно титровать смесь Са-Mg. Описаны радиометрическое и кондуктометрическое титрования. Особенно интересна термометрическая индикация точки эквивалентности применительно к анализу смеси С а-Mg, поскольку теплоты образования комплексонатов обоих металлов не только различны, но даже противоположны по знаку.
Число практических применений комплексонометрического определения Са огромно. Ниже приведены лишь некоторые из возможных случаев. Так как определение Са часто связано с определением Mg, рекомендуем читателю обратиться к разделам, касающимся определения смеси Са и Mg и жесткости воды. С использованием визуальной индикации проводятся анализы стеаратов , сахарных соков , казеина , воды , дождевой воды , фармацевтических препаратов , трикальцийфос-фата , технических фосфатов , растительных материалов , фотографических материалов , канифоли , а также определение свободной извести в силикатах и Са в каустической соде , причем в последнем случае применяют концентрирование Са на хелатообра-зующей ионообменной смоле-Дауэкс A-I.
Фотометрическое титрование с мурексидом используют для определения водорастворимой части гипса и анализа вод . Кальцеин используют в качестве фотометрического индикатора при определении Са в солях лития . При анализе фуража Са титруют с ртутным капельным электродом раствором ГЭДТА.
Смеси кальция с магнием. Отделение кальция от магния можно проводить различными способами. Разделение всегда возможно, но отнимает много времени. Для целей разделения целесообразно применять ионообменные смолы . Герке предлагает отделять Са в виде сульфита. Можно осаждать Са классическим способом в виде оксалата и после озоления и растворения осадка комплексонометрически оттитровывать.
В случае очень малого содержания Са осадок оксалата кальция можно растворить в кислоте, прибавить ЭДТА и после подщелачивания раствора оттитровать избыток ЭДТА. Однако после осаждения кальция в виде оксалата изменение окраски эриохрома черного Т при титровании Mg в фильтрате бывает недостаточно резким, поэтому количество применяемых оксалат-ионов ограничивают до минимума.
Более изящными являются методы, в которых избегают разделения обоих металлов. Наиболее часто применяемый метод состоит в титровании Са в сильнощелочном растворе в присутствии осадка гидроокиси магния и в определении суммы Са и Mg во второй аликвотной части раствора (причем все сказанное выше о титровании Mg принимается во внимание), с последующим вычислением содержания Mg по разности. Если в смеси много Са и мало Mg, вряд ли при анализе возникнут затруднения. Если ситуация менее благоприятна, следует обратить внимание на ряд обстоятельств, обсуждение которых можно найти в оригинальной литературе .
Присутствие Mg(OH)2 может мешать, во-первых, потому, что имеется возможность соосаждения Са, во-вторых, потому, что изменение окраски индикатора может стать не резким из-за адсорбции красителя хлопьевидным осадком.
Прибавление сахара должно воспрепятствовать соосаждению Са, однако это не подтверждается другими авторами . Соосаждение можно, по мнению Флашки и Гудитца , свести до минимума, если вначале к нейтральному или кислому анализируемому раствору прибавить количество ЭДТА, не намного превышающее эквивалентное кальцию количество, и лишь после этого подщелачивать. Щелочь всегда следует прибавлять медленно по каплям и раствор хорошо перемешивать. Согласно Льюису с сотр. , при этом осаждается незначительное количество ЭДТА, которое при стоянии, благодаря рекристаллизации Mg(OH)2, снова переходит в раствор.
Для лучшего распознавания изменения окраски индикатора (например, мурексида) целесообразно, но, безусловно, не обязательно, проводить осаждение в мерной колбе; объем раствора следует довести до метки, и, после того как осадок отстоится, прозрачную аликвотную часть фильтрата использовать для обратного титрования небольшого избытка ЭДТА.
Баух и сотр. получили хорошие результаты при очень большом содержании Mg (определение около 0,5% Са, содержащегося в MgO), медленно осаждая Mg(OH)2 0,5 М раствором NaOH (к щелочи было прибавлено незначительное количество KCN и NH2OH НС1) при энергичном перемешивании и титруя Са непосредственно в суспензии раствором ЭДТА с CaL-Red в качестве индикатора. Важность медленного осаждения при энергичном перемешивании подчеркивают также Льюис и Мельник .
Как показывает исследование, проведенное Кении с сотр. , конечное значение рН раствора, применяемый индикатор и его количество также оказывают влияние на результаты титрования. В этом отношении важны результаты, полученные Белчером и др. . Из многочисленных испытанных индикаторов наиболее пригодным оказался калькой. Точка эквивалентности в присутствии осажденного Mg(OH)2 была более четкой, чем в чистых растворах Са, причем в присутствии Mg не были получены заниженные результаты для Са, что имеет место при применении других индикаторов (например, мурексида, метилтимолового синего или кальцеина).
Нечеткие переходы окраски, обусловленные адсорбцией индикатора осадком Mg(OH)2, можно улучшить, если индикатор прибавлять уже после осаждения магния, и, кроме того, если перед добавлением красителя выждать, пока осадок не приобретет кристаллический характер. Как указывают Лотт и Ченг , прибавление нескольких капель поливинилового спирта предотвращает уменьшение четкости перехода окраски индикатора. Аналогичное действие ацетилацетона наблюдали Бурже и др. .
Суммируя сказанное выше, можно отметить, что имеются различные возможности улучшения условий определения, но едва ли можно предложить удовлетворительную для всех случаев методику определения; для каждого конкретного случая следует подбирать оптимальные условия, для того чтобы достигнуть наибольшей точности. Поэтому неудивительно, что есть много сообщений об опытах, поставленных с целью избежать выделения в осадок Mg(OH)2-Для этой цели предлагаютприбавлять к раствору винную кислоту. Согласно нашим опытам и в соответствии с данными других авторов , винная кислота пригодна для предотвращения выпадения магния в осадок, но при этом получаются завышенные результаты для Са, если в качестве титранта использовать раствор ЭДТА. Если же вместо ЭДТА взять ГЭДТА , результаты определения Са получаются правильными, так как комплекс магния с этим компексоном менее стабилен, чем комплекс кальция. В этой связи интересно отметить, что точка эквивалентности титрования с кальконом получает ся резкой лишь тогда, когда соотношение Mg: Са равно, по крайней мере, 1.
Если сравнить эти сведения с упоминавшимися выше данными Белчера и др- , то следует признать, что до сих пор еще не ясно, каким образом осаждение магния и его комплексообразование влияют на образование комплекса Са-калькон в точке эквивалентности.
Одна из главных проблем определения Са в присутствии Mg состоит в отсутствии до сих пор простого индикатора на Са для визуальных определений, функционирующего при таких значениях рН, когда Mg еще остается в растворе. Рингбом разрешил это затруднение, применив косвенную индикацию точки эквивалентности с помощью системы Zn-ГЭДТА-цинкон. В растворе устанавливают рН = 9,5-10 с помощью буферного раствора, содержащего 25 г буры, 2,5 г NH4C1 и 5,7 г NaOH в 1 л.
В чистых растворах получаются очень резкие переходы окраски и правильные значения содержания Са. Но для этого необходимо, чтобы, во-первых, концентрация аммония соблюдалась очень точно и, во-вторых, отношение Са: Zn равнялось приблизительно 10; выполнение этих оптимальных условий при практическом проведении анализов, к сожалению, не всегда возможно. Другой путь описывают Флашка и Ганчоф : они титруют раствором ГЭДТА с мурексидом в качестве индикатора при рН около 10. При фотометрической индикации можно определять Са в присутствии более чем 100-кратного избытка Mg. Кальций в присутствии магния можно также потенциометрически титровать раствором ГЭДТА при рН = = 10 .
Следует сослаться еще на метод Штрафельда , в котором Mg осаждают фосфат-ионами при рН = 9 и затем в присутствии осадка определяют Са обратным потенциометрическим титрованием избытка ЭДТА титрованным раствором соли кальция с ртутным капельным электродом. Прибавленное количество фосфата должно быть очень точным. С одной стороны, этого количества должно хватить, чтобы снизить растворимость MgNH4P04 настолько, чтобы он не вступал в реакцию с ЭДТА, с другой - количество фосфата не должно быть слишком велико, так как в противном случае выпадает осадок Са3(Р04)2. Литературных данных, касающихся соосаждения Са, не имеется.
После всего сказанного еще раз подчеркиваем, что едва ли можно дать универсальную методику работы, однако существуют удовлетворительные модификации стандартных методов, основываясь на которых можно для всех случаев, встречающихся в практике, выбрать пригодную для работы методику. Не следует забывать, что большинство исследований проводится на чистых растворах, а при практическом анализе условия определения осложняются вследствие высокой концентрации солей, присутствия мешающих элементов и прибавленных для их устранения маскирующих веществ.
Наиболее изящными являются последовательные титрования, так как, с одной стороны, они экономят время, а с другой - требуют меньшего количества анализируемого раствора, что при
практических определениях часто очень важно. Такие опыты проводились и дали очень хорошие результаты, по крайней мере, на искусственных растворах. Кэрэш сначала титрует Са с мурексидом при рН = 13, затем подкисляют раствор, причем мурексид, гидролизуясь, разрушается, доводит рН до 10 и титрует Mg с эриохромом черным Т. Описанные выше затруднения, возникающие при определении Са в присутствии Mg (ОН) 2, естественно, имеют значение и здесь.
Лотт и Ченг сначала титруют Са с кальконом при высоком значении рН, затем снижают рН раствора, при-, бавляя кислоту и хлорид аммония, и продолжают титрование с эриохромом черным Т для определения Mg. Шмидт и Рейли исключают ошибку, вызываемую осаждением магния, для чего они сначала в прозрачном растворе при рН = 9,5-10 титруют Са раствором ГЭДТА в присутствии индикаторной системы Рингбома, представляющей собой смесь Zn - ГЭДТА - цинкон, затем прибавляют KCN для маскирования Zn и титруют Mg раствором ЭДТА с эриохромом черным Т. Флашка и Ганчоф пользуются фотометрической индикацией точки эквивалентности. Сначала они титруют Са с мурексидом раствором ГЭДТА при рН = 10, затем прибавляют эриохром черный Т, меняют длину волны света и определяют Mg титрованием раствором ЭДТА. Субмикрограммовые количества Са и Mg можно определить по одной кривой фотометрического титрования; при этом используют комплекс Mg-кал-магит в качестве самоиндицирующей системы для установления конечной точки титрования Са по наклону кривой титрования .
Определение Са и Mg упомянутыми выше методами применяют в анализе разнообразных материалов, например лимфы насекомых , известняка , доломита , магнезита , известковых и силикатных пород , почв , стеклянных порошков , стекла , руд и шлаков , цемента , стали и подобных материалов ; каменной соли , рассолов, морской воды и других растворов с большим содержанием щелочи , а также сварочной проволоки, содержащей Мn , пульпы , сточных вод угольных разработок, обычных вод и специальных минеральных вод , молока , консервированных фруктовых соков , фармацевтических препаратов , растительных материалов после озоления , в частности табачного пепла , жи вотных тканей н биологических материалов вообще .
Кальций и магний в биологических жидкостях. Комплексонометрическое определение Са и (или) Mg в крови, сыворотке, моче и спинномозговой жидкости в настоящее время является стандартным титриметрическим методом, применяемым почти во всех лабораториях. Число публикаций, относящихся к этой области, превысило сотню.
Так как многие из предложенных методов лишь незначительно различаются в деталях, здесь для объяснения принципов определений будут рассмотрены только некоторые из опубликованных работ.
Кальций в сыворотке впервые определили Гринблатт и Гартман , проводя титрование с мурексидом в сильнощелочном растворе. Другие авторы описывают этот же метод лишь с небольшими изменениями или с фотометрической индикацией .
Применяются и другие индикаторы, например кальцеин , преимущественно в Уф-области , причем можно вычертить кривую титрования ; этим методом можно анализировать очень малые количества сыворотки (20 мкл) ; можно применять фотометрическую индикацию . Кроме того, применяют CAL-Red , калькой , фталеинкомплексон , кислотный ализариновый черный SN и флуоресцентные индикаторы . Обстоятельное сравнение (например ) этих методов с классическим оксалатным методом отчетливо показало преимущества комплексонометрического метода.
Кальций в моче можно определять стандартным методом с ЭДТА так же, как его определяли в других материалах , или фотометрическим титрованием , или с добавлением флуорексона . Вследствие повышенного содержания фосфатов в моче при ее анализе часто оказывается полезным сильное разбавление анализируемого раствора или, во избежание выпадения в осадок трудно растворимых соединений, применение обратного титрования.
Кроме этих методов, разработанных специально для определения Са, подходящие способы определения Са могут встретиться и среди описываемых далее методов определения Са и Mg, так как многие определения Са связаны с определением Mg.
Первое определение магния в сыворотке описали Голасек и Флашка . Кальций осаждают в виде оксалата и титруют после растворения осадка, тогда как Mg определяют в фильтрате после центрифугирования. Преимущество этого метода состоит в том, что оба металла можно определять в одном растворе. Аналогичным преимуществом обладает метод, предложенный Гьессингом , в котором осуществляется последовательное титрование. Сначала Са титруют фотометрически с мурексидом в щелочном растворе (NaOH), причем небольшие количества Mg(OH)2, остающиеся в растворе, по-видимому, в коллоидной форме, не мешают. Затем прибавляют глицин и кипятят. При этом мурексид разрушается и гидроокись магния растворяется; после этого титруют Mg с эриохромом черным Т Однако большинство методов основано на использовании двух аликвотных проб. В одной пробе Са титруют в растворе с высоким значением рН с мурексидом (см выше) или с другим индикатором, например Эрио SE , а в другой - оттитровывают сумму Са и Mg.
В последнем титровании обычно пользуются эриохромом черным Т. Метод пригоден для работы с ультрамикроколичествами и выигрывает в точности, если применять фотометрическое титрование . Процесс титрования можно автоматизировать .
Кальций и магний в моче можно определять так же, как и в сыворотке, но с небольшими изменениями .
Кальций и магний в плазме и в спинномозговой жидкости определяют совершенно так же, как и в сыворотке.
Определение жесткости воды. Определение жесткости воды уже очень давно было описано Шварценбахом с сотр. и является первым методом комплексонометрического титрования, использованным в практике. В литературе можно найти многочисленные методики определения жесткости воды , включая микроопределения .
Следует различать две группы методов: определение общей жесткости и раздельное определение кальциевой и магниевой жесткости. При определении общей жесткости титруют сумму Са и Mg. Титрование обычно проводят в растворе с рН = 10 с эриохромом черным Т в качестве индикатора. Чтобы переход окраски индикатора был резким, необходимо присутствие по меньшей мере 5% Mg (по отношению к содержанию Са).
Так как для разных по происхождению вод это условие не всегда соблюдается, следует прибавлять известное количество Mg и учитывать его при вычислениях или,-еще лучше, вводить в анализируемый раствор в виде комплекса магния с ЭДТА. При выполнении серийных анализов гораздо проще употребить титрованный раствор, в котором наряду с ЭДТА (H2Y2~) содержится необходимое количество MgY2~.
При изучении факторов, мешающих этим титрованиям, выяснено , что к ним относятся главным образом небольшие примеси тяжелых металлов, которые или вызывают перерасход титранта, или блокируют индикатор. Их удаление не вызывает затруднений, если прибавить в качестве маскирующих веществ смесь KCN с аскорбиновой кислотой или триэтаноламин. Хорошим маскирующим веществом для большинства металлов, кроме Al, является также Na2S . Часто маскирующие вещества вводят в буферный раствор.
Ган избегает помех или снижает их, оттитровывая известное количество стандартного раствора ЭДТА анализируемой водой. Однако этот прием затруднителен для практического применения. При титровании с хромазуролом S помехи менее опасны , так как этот краситель мало подвержен блокированию. Однако переход окраски в этом случае менее резок, чем при использовании эриохрома черного Т.
При раздельном определении кальциевой и магниевой жесткости обычно используют две аликвотные порции раствора. В одной части раствора титруют Са при высоком значении рН, в другой при рН = 10 титруют сумму Са и Mg. Магний вычисляют по рязности.
Титрование кальция, как правило, не вызывает затруднений, так как во всех нормальных водах содержание Са сильно превышает содержание Mg.
Для анализа вод, содержащих полифосфаты, Брук предложил проводить предшествующее титрованию Са разделение методом ионного обмена. Шнейдер и др. при определении жесткости сахарного сиропа применяли в качестве индикатора эриохром сине-черный В.
Комплексонометрическому определению постоянной жесткости может предшествовать кислотно-основное определение временной жесткости, после которого комплексонометрическое титрование можно проводить непосредственно в том же самом растворе. Сообщают о фотометрических титрованиях, представляющих интерес для анализа окрашенных вод. Фотометрическая индикация позволяет автоматизировать титрование .
Лаци описывает полуавтоматический метод, в котором полученная в присутствии эриохрома черного Т кривая титрования вычерчивается самописцем. На кривой получаются два перегиба, первый из которых соответствует окончанию титрования Са. Таким образом, возможно одновременное определение кальциевой и магниевой жесткости. Эрдей и др. тоже получили два перегиба на кривой при высокочастотном титровании.
Кондуктометрическое титрование оправдало себя при анализе мутных и окрашенных вод. Поскольку в природных водах концентрация солей обычно незначительна, для их анализа весьма пригоден кондуктометрический метод, благодаря отсутствию мешающего определению электропроводности фона.
Прямое определение магния с эриохромом черным Т
Реактивы ЭДТА, 0,01 М раствор. Эриохром черный Т.
Буферный раствор, рН =10 .
Ход определения. Концентрация Mg в анализируемом растворе не должна превышать 10 -2 М. Кислые анализируемые растворы предварительно нейтрализуют едким натром. Затем к каждым 100 мл раствора приливают 2 мл буферного раствора, несколько капель эриохрома черного Т и титруют до перехода красной окраски в синюю.
С последней каплей раствора титранта должен исчезнуть красноватый оттенок индикатора. Так как реакции комплексообразования протекают не мгновенно, вблизи конечной точки титрование замедляют.
Замечания. Кривые, изображенные на рис. 32 и полученные комбинацией кривых, изображенных на рис. 4 и 23, показывают, что в процессе титрования следует довольно точно поддерживать значение рН = 10. Как слишком низкое, так и слишком высокое значение рН ухудшает распознаваемость точки эквивалентности. Поэтому кислые анализируемые растворы до прибавления буфер-

не вводить в раствор дополнительное количество ионов аммония. При правильном выборе условий титрования точка эквивалентности бывает настолько резкой, что можно титровать даже 0,001 М раствором ЭДТА.
Определение кальция с эриохромом черным Т по методу вытеснения
Реактивы
ЭДТА, 0,01 М раствор.
Эриохром черный Т.
Буферный раствор, рН = 10.
Комплекс магния с ЭДТА, 0,1 М раствор.
Ход определения. Концентрация ионов кальция не должна превышать 10 -2 М. Если анализируемый раствор кислый, его нейтрализуют едким натром. К каждым 100 мл анализируемого раствора приливают 2 мл буферного раствора, 1 мл 0,1 М раствора MgY,2-4 капли эриохрома черного Т и титруют до перехода красной окраски в синюю. С последней каплей раствора титранта должен совершенно исчезнуть красноватый оттенок. Вблизи конечной точки титрование замедляют.
Замечания. Кривые, приведенные на рис. 33 и полученные комбинацией кривых, изображенных на рис. 5 и 24, показывают, как изменяется цвет эриохрома черного Т, если Са2+-ионы титруют без добавления комплексоната магния. При этом даже при рН = 11 не получается резкого перехода окраски, кроме того, в таком сильнощелочном растворе не получается чистого синего цвета, так как в этой области рН эриохром черный Т ведет себя как кислотно-основной индикатор .
Кривые, изображенные на рис. 34, показывают улучшения, достигнутые в результате прибавления комплексоната магния. Так как комплексонат кальция устойчивее комплексоната магния, происходит вытеснение Mg и - как следствие - одновременное титрование Са и Mg (см. рис. 11).
Кривые, изображенные на рис. 34, получены комбинацией рис. 11 и 23. Они показывают, что добавление только 1% Mg уже значительно улучшает распознаваемость точки эквивалентности. При прибавлении 10% Mg получают практически максимальный возможный эффект. Дальнейшее прибавление MgY2-привело бы лишь к ненужному повышению ионной силы раствора и уменьшению скачка pMg. При правильном проведении титрования изменение окраски бывает настолько резким, что можно проводить микроопределения, используя даже 0,001 М раствор ЭДТА.

При фотометрической индикации точки эквивалентности результаты титрования заметно улучшаются.
Прямое определение кальция с кальконом
Реактивы
ЭДТА, 0,01 М раствор. Калькой.
Едкое кали, 2 М раствор. Диэтиламин.
Ход определения. Концентрация кальция в титруемом растворе должна быть около 10 -2 М. Кислые растворы сначала нейтрализуют едким натром или едким кали. К каждым 100 мл нейтрализованного анализируемого раствора приливают 5-7 мл диэтиламина. Этого количества вполне достаточно для установления значения рН раствора около 12,5. Затем прибавляют индикатор калькой и титруют (тотчас, чтобы предотвратить выпадение осадка CaCO3) раствором ЭДТА до устойчивой чисто-синей окраски.
Замечания. Требуемое значение рН титруемого раствора можно установить также с помощью КОН или NaOH.
Некоторые наблюдатели отмечают, что точка эквивалентности при титровании с кальконом получается более резкой, если присутствует небольшое количество магния. В этом случае, если Mg в анализируемом растворе отсутствует, прибавляют 1-2 мл 0,1 М раствора соли магния. Затем медленно при сильном перемешивании подщелачивают раствор. Количество диэтиламина, указанное выше, достаточно для установления соответствующего рН в присутствии Mg. При титровании в присутствии Mg иногда после конечной точки раствор при стоянии вновь обесцвечивается; тогда следует прибавить еще 1-2 капли титрующего раствора ЭДТА, чтобы получить устойчивую синюю окраску. Поэтому, если в растворе присутствует магний, перед отсчетом по бюретке следует подождать около полминуты.
В качестве титранта вместо ЭДТА можно применять ГЭДТА, особенно тогда, когда определение Са проводят в присутствии большого количества Mg и для предотвращения выпадения Mg в осадок прибавляют винную кислоту.