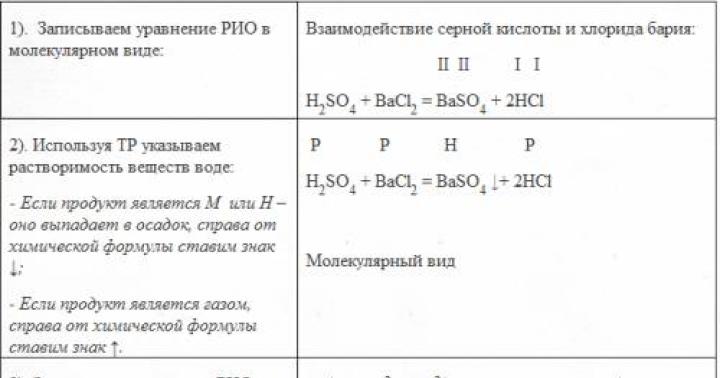
(1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки . Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
Свойства пептидной связи
Как и в случае любых амидов, в пептидной связи за счет резонанса канонических структур связь C-N между углеродом карбонильной группы и атомом азота частично имеет характер двойной:
Это проявляется, в частности, в уменьшении её длины до 1,33 ангстрема :

Это обусловливает следующие свойства:
- 4 атома связи (C, N, O и H) и 2 α-углерода находятся в одной плоскости. R-группы аминокислот и водороды при α-углеродах находятся вне этой плоскости.
- H и O в пептидной связи, а также α-углероды двух аминокислот трансориентированы (транс-изомер более устойчив). В случае L-аминокислот, что имеет место во всех природных белках и пептидах, R-группы также трансориентированы.
- Вращение вокруг связи C-N затруднено, возможно вращение вокруг С-С связи.
Ссылки
Wikimedia Foundation . 2010 .
Смотреть что такое "Пептидная связь" в других словарях:
- (CO NH) химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков … Большой Энциклопедический словарь
пептидная связь - – амидная связь (NH CO), образующаяся между амино и карбоксильной группами аминокислот в результате реакции дегидратации … Краткий словарь биохимических терминов
пептидная связь - Ковалентная связь между альфа аминогруппой одной аминокислоты и альфа карбоксильной группой другой аминокислоты Тематики биотехнологии EN peptide bond … Справочник технического переводчика
Пептидная связь - * пептыдная сувязь * peptide bond ковалентная связь между двумя аминокислотами, возникающая в результате соединения α аминогруппы одной молекулы с α карбоксильной группой др. молекулы, с одновременным удалением воды … Генетика. Энциклопедический словарь
ПЕПТИДНАЯ СВЯЗЬ - хим. Связь СО NH , характерная для аминокислот в молекулах белков и пептидов. П. с. встречается и в некоторых др. органических соединениях. При ее гидролизе образуются свободная карбоксильная группа и аминогруппа … Большая политехническая энциклопедия
Вид амидной связи; возникает в результате взаимодействия а аминогруппы (NH2) одной аминокислоты с? карбоксильной группой (СООН) др. аминокислоты. Группа С(О) NH в белках и пептидах находится в состоянии кето енольной таутомерии (существование… … Биологический энциклопедический словарь
- (СО NH), химическая связь, соединяющая аминогруппу одной аминокислоты с карбоксильной группой другой в молекулах пептидов и белков. * * * ПЕПТИДНАЯ СВЯЗЬ ПЕПТИДНАЯ СВЯЗЬ (CO NH), химическая связь, соединяющая аминогруппу одной аминокислоты… … Энциклопедический словарь
Peptide bond пептидная связь. Pазновидность амидной связи, образуется между α карбоксильной и α аминогруппой двух аминокислот. (
Cодержание:
Польза аминокислот при силовых тренировках. Четыре группы, отражающие формирование структуры молекулы белка.
Белок представляет собой полимерную молекулу, в которой есть группа мономеров (то есть мелких элементов) – аминокислот. От того, какие аминокислоты формируют состав белка, а также от их чередования, зависят свойства и действие последнего. Всего в организме человека можно найти двадцать аминокислот, которые в различных сочетаниях встречаются в различном по своей конструкции белке. Условно все компоненты белковой молекулы можно рассматривать в качестве букв алфавита, на которых зафиксирован определенный объем информации. Только слово может свидетельствовать о каком-либо предмете или действии, а набор аминокислот – о функции конкретного белка, его возможностях и эффективности работы.
О пользе
Об особенностях и преимуществах столь полезных элементов написано сотни статей и книг. Почему бы и нет, ведь они действительно формируют наш организм, являются составляющими элементами белка и помогают развиваться во всех отношениях. К основным свойствам можно отнести:
- ускорение синтеза белка. Наличие в организме полного комплекса аминокислот способствует стимуляции выработки инсулина и активации mTor. Вместе эти механизмы способствуют запуску роста мышечной массы;
- источник энергии. Такие компоненты проходят по другому пути метаболизма и по своей функции отличаются от углеводов. В итоге организм получает большие объемы энергии и заполняется аминокислотным пулом. Итог – мышцы растут намного быстрее;
- подавление катаболических процессов. С их помощью можно навсегда забыть, что такое разрушение собственных мышц, ведь в организме всегда будет материал для построения новых белковых молекул;
- снижение жира. Полезная функция – помощь в образовании лептина, который способствует максимально быстрому сжиганию жировых отложений. Все это позволяет добиться максимального эффекта.
К полезным действиям аминокислотных групп можно также отнести участие в обмене азота в организме, восстановление поврежденных тканевых участков, обеспечение метаболических процессов, полноценное восстановление мышц, снижение уровня сахара в крови.
Кроме этого, к полезным действиям можно отнести стимуляцию гормона роста, повышение выносливости, обеспечение организма необходимым объемом энергии, нормализацию обменных процессов, стимуляцию иммунной системы, нормализацию пищеварительного процесса, защиту от радиации и так далее.
Структура
Химики выделяют четыре основные группы, которые отображают суть структурного формирования молекулы столь необходимого и важного для человеческого организма компонента. Таких группы всего четыре и у каждой из них есть свои особенности формирования – первичная, вторичная, третичная и четвертичная. Рассмотрим эти нюансы более подробно:

Вывод
Вот мы вкратце и рассмотрели, как аминокислоты формируют столь необходимый человеку элемент.
Пептидная связь – это связь между альфа-карбоксильной группой одной аминокислоты и альфа-аминогруппой другой аминокислоты.
Рис 5. Образование пептидной связи
К свойствам пептидной связи относятся:
1. Трансположение заместителей (радикалов) аминокислот по отношению к C-N связи. Рис 6.

Рис 6. Радикалы аминокислот находятся в транс-положении.
2. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи. Рис 7, а.
3. Наличие кето
формы и енол
ьной формы. Рис 7, б 
Рис 7. а) б)
4. Способность к образованию двух водородных связей с другими пептидными группами. Рис 8.

5. Пептидная связь имеет частично характер двойной связи. Ее длина меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено.
Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию(пространственное расположение атомов).
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру
белка. Она уникальна для любого белка и определяет его форму, а также различные свойства и функции.
Большинство белков имеют вид спирали в результате образования водородных связей между-CO-
и -NH-
группами разных аминокислотных остатков полипептидной цепи. Водородные связи непрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль - вторичная структура
белка.
Третичная структура - трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация -глобула . Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Четвертичная структура
характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка, в данном случае основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия.
Такая сложность структуры белковых молекул связана с разнообразием функций, которые свойственны этим биополимерам, например, защитная, структурная и т.д.
Нарушение природной структуры белка называют денатурацией
. Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном - третичная, а затем - вторичная, и белок остается в виде полипептидной цепи, то есть в виде первичной структуры.
Этот процесс частично обратим: если не нарушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенность строение макромолекулы белка определяются его первичной структурой.
Аминокислоты способны соединяться между собой связями, которые называются пептидными , при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то новое соединение называется пептид ; если от 10 до 40 аминокислот – полипептид , если более 40 аминокислот – белок .
Пептидная связь – это связь между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой аминокислоты.
Образование пептидной связи
При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс "-ил", только последняя аминокислота сохраняет свое название неизменным. Например, аланил -серил -триптофан или γ-глутаминил -цистеинил -глици н (по-другому называемый глутатион ).
К свойствам пептидной связи относятся:
1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.

2.Транс-положение заместителей
Радикалы аминокислот по отношению к оси пептидной C-N -связи находятся по "разные" стороны, в транс-положении.

3. Две равнозначные формы
Пептидная связь находится в кетоформе и енольной форме.

4. Способность к образованию водородных связей.
Атомы кислорода и водорода, входящие в пептидную группу, обладают способностью образовывать водородные связи с атомами кислорода и водорода других пептидных групп.

5. Пептидная связь имеет частично характер двойной связи.
Длина пептидной связи меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено. Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
α-Аминокислоты могут ковалентно связы-ваться друг с другом с помощью пептидных свя-зей . Карбоксильная группа одной аминокислоты ковалентно связывается с аминогруппой другой аминокислоты. При этом возникает R-CO-NH -R связь, называемая пептидной связью. При этом происходит отщепление мо-лекулы воды.
При помощи пептидных связей из аминокислот образуются белки и пептиды. Пептиды, содержащие до 10 аминокислот, называют олигопептиды . Час-то в названии таких молекул указывают количе-ство входящих в состав олигопептида аминокис-лот: трипептид, пентапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют «полипептиды », а полипептиды, состоя-щие из более чем 50 аминокислотных остатков, обычно называют белками. Мономеры аминокислот, входящих в состав бел-ков, называют «аминокислотные остатки». Амино-кислотный остаток, имеющий свободную амино-группу, называется N-концевым и пишется слева, а имеющий свободную C-карбоксильную груп-пу — С-концевым и пишется справа. Пептиды пи-шутся и читаются с N-конца.
Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой спо-собна к свободным вращениям (хотя ограниче-на размером и характером радикалов), что позволяет полипептидной цепи принимать раз-личные конфигурации.
Пептидные связи обычно расположены в транс-конфигурации, т.е. α-углеродные атомы располагаются по разные стороны от пептид-ной связи. В результате боковые радикалы ами-нокислот находятся на наиболее удалённом рас-стоянии друг от друга в пространстве. Пептидные связи очень прочны и являются ковалентными .
В организме человека вырабатывается мно-жество пептидов, участвующих в регуляции раз-личных биологических процессов и обладающих высокой физиологической активностью. Такими являются целый ряд гормонов - окситоцин (9 аминокислотных остатков), вазопрессин (9), брадикинин (9) регулирующий тонус сосудов, тиреолиберин (3), антибиотики - грамицидин, пептиды, обладающие обезболивающим дей-ствием (энкефалины (5) и эндорфины и другие опиоидные пептиды). Обезболивающий эф-фект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина;
Окситоцин выделяется в кровь во время корм-ления ребёнка, вызывает сокращение миоэпителиальных клеток протоков молочных желёз и стимулирует выделение молока. Кроме того, окситоцин влияет на гладкую мускулатуру мат-ки во время родов, вызывая её сокращение.
В отличие от окситоцина, основное физио-логическое действие вазопрессина — увеличе-ние реабсорбции воды в почках при уменьше-нии АД или объёма крови (поэтому другое название этого гормона — антидиуретический). Кроме того, вазопрессин вызывает сужение сосудов .
Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертич-ной структурами. Существуют общие правила, по которым идёт формирование про-странственных структур белков.
Первичная структура белка - это ковалентная структура остова полипептидной цепи - линейная последовательность аминокислотных остатков, соединенных друг с другом пептидными связями. Первичная структура каждого индивидуально-го белка закодирована в участке ДНК, называе-мом геном. В процессе синтеза белка информа-ция, находящаяся в гене, сначала переписывается на мРНК, а затем, используя мРНК в качестве матрицы, на рибосоме происходит сборка пер-вичной структуры белка. Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для дан-ного белка первичную структуру.
Инсулин является первым белком, первичная структура которого была расшифрована. Инсулин — белковый гормон; содержит 51 аминокислоту, состоит из двух полипептидных цепей (цепь А содержит 21 аминокислоту, цепь В — 30 аминокислот). Инсулин синтезируется в β-клетках поджелудочной железы и секретируется в кровь в ответ на повышение концентра-ции глюкозы в крови. В структуре инсулина имеются 2 дисульфидные связи, соединяющие 2 полипептидные цепи А и В, и 1 дисульфидная связь внутри цепи А
Вторичная структура белков- это конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами -NH и -СО. Существует два основных способа укладки цепи — α-спираль и β-структура .
α -Спираль

Вданном типе структуры пептидный остов закручивается в виде спирали за счёт образова-ния водородных связей между атомами кисло-рода карбонильных групп и атомами водорода ами-ногрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали. На один виток α-спирали приходится 3,6 аминокислотных остатка.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пеп-тидных групп. В результате α-спираль «стягива-ется» множеством водородных связей. Несмотря на то, что данные связи относят к разряду сла-бых, их количество обеспечивает максимально возможную стабильность α-спирали. Так как все гидрофильные группы пептидного остова обыч-но участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) α-спиралей уменьша-ется, а их гидрофобность увеличивается.
α-Спиральная структура — наиболее устой-чивая конформация пептидного остова, отве-чающая минимуму свободной энергии. В резуль-тате образования α-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.

Радикалы аминокислот находятся на наружной стороне α -спирали и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, характерных для вторич-ной структуры, но некоторые из них могут нару-шать формирование α-спирали.
К ним относятся:
Пролин. Его атом азота входит в состав жёс-ткого кольца, что исключает возможность вращения вокруг -N-CH- связи. Кроме того, у атома азота пролина, образующего пептид-ную связь с другой аминокислотой, нет ато-ма водорода. В результате пролин не спосо-бен образовать водородную связь в данном месте пептидного остова, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб;
Участки, где последовательно расположены несколько одинаково заряженных радика-лов, между которыми возникают электро-статические силы отталкивания;
Участки с близко расположенными объём-ными радикалами, механически нарушаю-щими формирование а-спирали, например метионин, триптофан.
β -Структура

β-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между раз-ными полипептидными цепями , β-Структура образует фигуру, подобную листу, сложенному «гармошкой», — β-складчатый слой.
Складчатый слой фиброина шелка: зигзагообразные антипараллельные складки.
Когда водородные связи образуются между атомами пептидного остова различных полипеп-тидных цепей, их называют межцепочечными связями. Водородные связи, возникающие меж-ду линейными участками внутри одной полипеп-тидной цепи, называют внутрицепочечными. В β-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Третичная структура белков — трёхмерная про-странственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
Третичная структура свернутой полипептиднойцепи стабилизируется рядом взаимодействий между радикалами аминокислот: это гидрофобные взаимодействия, электростатическое притяжение, водородные связи, а также дисульфидные -S-S- связи.
Гидрофильные радикалы аминокислот стре-мятся образовать водородные связи с водой и поэтому в основном располагаются на поверх-ности белковой молекулы.
Все гидрофильные группы радикалов амино-кислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ион-ных и водородных связей.

Типы связей, возникающих между радикалами аминокислот при формировании третичной структуры белка. 1 — ионные связи; 2 — водородные связи; 3 — гидро-фобные связи; 4 — дисульфидные связи.
Ионные связи (электростатическое притяжение)могут возникать между от-рицательно заряженными (анионными) карбоксильными группами радикалов аспарагиновой и глутаминовой кислот и по-ложительно заряженными (катионными) группами радикалов лизина, аргинина или гистидина.
Водородные связи возникают между гидро-фильными незаряженными группами (таки-ми как -ОН, -CONH 2 , SH-группы) и любы-ми другими гидрофильными группами. Третичную структуру некоторых белков ста-билизируют дисульфидные связи, образующие-ся за счёт взаимодействия SH-групп двух остатков цистеина. Эти два остатка цистеина могут находиться далеко друг от друга в линейной первичной структуре белка, но при формиро-вании третичной структуры они сближаются и образуют прочное ковалентное связывание ра-дикалов.
Большинство внутриклеточных белков лише-но дисульфидных связей. Однако такие связи распространены в белках, секретируемых клет-кой во внеклеточное пространство. Полагают, что эти ковалентные связи стабилизируют кон-формацию белков вне клетки и предотвращают их денатурацию. К таким белкам относят гор-мон инсулин и иммуноглобулины.
Четвертичная структура белков. Многие белки содержат в своём составе толь-ко одну полипептидную цепь. Такие белки на-зывают мономерами. К мономерным относят и белки, состоящие из нескольких цепей, но соединённых ковалентно, например дисульфидными связями (поэтому инсулин следует рассматривать как мономерный белок).
 |
В то же время существуют белки, состоя-щие из двух и более полипептидных цепей. После формирования трёхмерной структуры каждой полипептидной цепи они объединя-ются с помощью тех же слабых взаимодей-ствий, которые участвовали в образовании третичной структуры: гидрофобных, ионных, водородных.
Способ упаковки двух или более отдельных глобулярных белков в молекуле является четвертичной структурой белка.
Отдельные поли-пептидные цепи в таком белке носят название мономеров, или субъединиц. Белок, содержа-щий в своём составе несколько мономеров, называют олигомерным. Олигомерные глобулярные белки обычно имеют крупные размеры и часто выполняют в ферментативных комплексах регуляторные функции.
Поддержание характерной для белка конформации возможно благодаря возникновению множества слабых связей между различными участками полипептидной цепи. Конформация белка может меняться при изменении химических и физических свойств среды, а также при взаи-модействии белка с другими молекулами. При этом происходит изменение пространственной структуры не только участка, контактирующего с другой молекулой, но и конформации белка в целом.
Конформационные изменения играют огромную роль в функционировании белков в живой клетке. Разрыв большого количества слабых связей в молекуле белка под воздействием органических растворителей, ультразвука, температуры, pH ,и т.д. приводит к разрушению её нативной конформации. Развертывание цепей без разрушения их ковалентных связей называется денатурацией . Такой белок биологически неактивен . При денатурации белков не происходит разрыва пептидных связей, т.е. первичная структура белка не нарушается, однако его функция утрачивается.