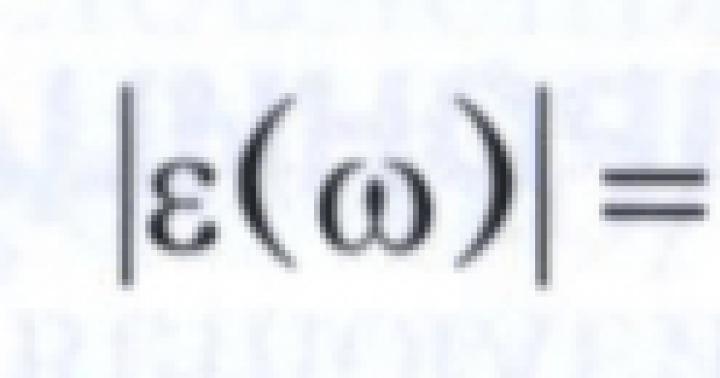acizi- Acest substanțe complexe, ale căror molecule constau din atomi de hidrogen care pot fi înlocuiți și reziduuri acide.
Reziduul acid are o sarcină negativă.
Acizi anoxici: HCl, HBr, H 2 S etc.
Un element care, împreună cu atomii de hidrogen și oxigen, formează o moleculă de acid care conține oxigen se numește formatoare de acid.
În funcție de numărul de atomi de hidrogen dintr-o moleculă, acizii sunt împărțiți în monobazăși polibazic.
Acizii monobazici conțin un atom de hidrogen: HCl, HNO3, HBr etc.
Acizii polibazici conțin doi sau mai mulți atomi de hidrogen: H 2 SO 4 (dibazic), H 3 PO 4 (tribazic).
În acizii fără oxigen, vocala de legătură „o” și cuvintele „... acid clorhidric". De exemplu: HF este acid fluorhidric.
Dacă elementul care formează acid prezintă starea de oxidare maximă (corespunde numărului de grup), atunci se adaugă numele elementului „... nu acid". De exemplu:
HNO 3 - azot și eu acid (deoarece atomul de azot are o stare de oxidare maximă de +5)
Dacă starea de oxidare a elementului este sub maxim, atunci se adaugă „... pură acid":
1+3-2
HNO 2 - azot Adevărat acid (deoarece elementul acid N are o stare de oxidare minimă).
H3PO4 - orto acid fosforic.
HPO 3 - meta acid fosforic.
Formule structurale ale acizilor.
Într-o moleculă de acid care conține oxigen, un atom de hidrogen este legat de un atom al unui element care formează acid printr-un atom de oxigen. Prin urmare, la compilarea unei formule structurale, toți ionii de hidroxid trebuie mai întâi atașați la atomul unui element care formează acid.
Apoi conectați atomii de oxigen rămași cu două liniuțe direct la atomii elementului care formează acid (Fig. 2).
acizi- electroliți, în timpul disocierii cărora din ionii pozitivi se formează numai ionii H +:
HNO3 ↔ H++ + NO3-;
CH 3 COOH ↔ H + +CH 3 COO -.
Toți acizii sunt clasificați în anorganici și organici (carboxilici), care au și clasificări proprii (interne).
În condiții normale, o cantitate semnificativă de acizi anorganici există în stare lichidă, unii în stare solidă(H3PO4, H3BO3).
Acizii organici cu până la 3 atomi de carbon sunt lichide ușor mobile, incolore, cu un miros înțepător caracteristic; acizii cu 4-9 atomi de carbon sunt lichide uleioase cu miros neplăcut, iar acizii cu cantitate mare atomii de carbon sunt solide care sunt insolubile în apă.
Formule chimice ale acizilor
Formule chimice Să luăm în considerare exemplul mai multor reprezentanți (atât anorganici, cât și organici): acid clorhidric -HCl, acid sulfuric - H 2 SO 4, acid fosforic - H 3 PO 4, acid acetic- CH 3 COOH și acid benzoic - C 6 H 5 COOH. Formula chimică arată compoziția calitativă și cantitativă a moleculei (câți și ce atomi sunt incluși într-un anumit compus) Folosind formula chimică, puteți calcula greutatea moleculară a acizilor (Ar (H) \u003d 1 amu, Ar ( Cl) \u003d 35,5 a.m.). m.u., Ar (P) = 31 a.m.u., Ar (O) = 16 a.m.u., Ar (S) = 32 a.m.u., Ar (C) = 12 a.m.u.):
Mr(HCl) = Ar(H) + Ar(Cl);
Mr(HCl) = 1 + 35,5 = 36,5.
Mr(H2SO4) = 2×Ar(H) + Ar(S) + 4×Ar(O);
Domnul(H 2 SO 4) \u003d 2 × 1 + 32 + 4 × 16 \u003d 2 + 32 + 64 \u003d 98.
Mr(H3PO4) = 3×Ar(H) + Ar(P) + 4×Ar(O);
Domnul(H 3 PO 4) \u003d 3 × 1 + 31 + 4 × 16 \u003d 3 + 31 + 64 \u003d 98.
Mr(CH3COOH) = 3×Ar(C) + 4×Ar(H) + 2×Ar(O);
Mr(CH 3 COOH) = 3x12 + 4x1 + 2x16 = 36 + 4 + 32 = 72.
Mr(C6H5COOH) = 7×Ar(C) + 6×Ar(H) + 2×Ar(O);
Mr(C6H5COOH) = 7x12 + 6x1 + 2x16 = 84 + 6 + 32 = 122.
Formule structurale (grafice) ale acizilor
Formula structurală (grafică) a unei substanțe este mai vizuală. Acesta arată modul în care atomii sunt conectați între ei în cadrul unei molecule. Indicăm formule structurale fiecare dintre compușii de mai sus:
Orez. 1. Formula structurală a acidului clorhidric.

Orez. 2. Formula structurală a acidului sulfuric.

Orez. 3. Formula structurală a acidului fosforic.

Orez. 4. Formula structurală a acidului acetic.

Orez. 5. Formula structurală a acidului benzoic.
Formule ionice
Toți acizii anorganici sunt electroliți, adică. capabil să se disocieze într-o soluție apoasă în ioni:
HCl ↔ H + + Cl -;
H2S04↔ 2H + + SO42-;
H3PO4 ↔ 3H + + PO43-.
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercițiu | Cu ardere completă 6 g materie organică S-au format 8,8 g de monoxid de carbon (IV) și 3,6 g de apă. Determinați formula moleculară a substanței arse dacă se știe că masa sa molară este de 180 g/mol. |
| Decizie | Să facem o schemă a reacției de ardere compus organic notând numărul de atomi de carbon, hidrogen și oxigen ca „x”, „y” și respectiv „z”: C x H y Oz + Oz →CO2 + H2O. Să determinăm masele elementelor care alcătuiesc această substanță. Valorile maselor atomice relative luate din Tabelul periodic al lui D.I. Mendeleev, rotunjit la numere întregi: Ar(C) = 12 a.m.u., Ar(H) = 1 a.m.u., Ar(O) = 16 a.m.u. m(C) = n(C)×M(C) = n(CO2)×M(C) = ×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = ×M(H); Calculați mase molare dioxid de carbon si apa. După cum se știe, masa molară a unei molecule este egală cu suma maselor atomice relative ale atomilor care alcătuiesc molecula (M = Mr): M(CO 2) \u003d Ar (C) + 2 × Ar (O) \u003d 12+ 2 × 16 \u003d 12 + 32 \u003d 44 g / mol; M(H 2 O) \u003d 2 × Ar (H) + Ar (O) \u003d 2 × 1 + 16 \u003d 2 + 16 \u003d 18 g / mol. m(C)=×12=2,4 g; m (H) \u003d 2 × 3,6 / 18 × 1 \u003d 0,4 g. m(O) \u003d m (C x H y O z) - m (C) - m (H) \u003d 6 - 2,4 - 0,4 \u003d 3,2 g. Să definim formula chimică a compusului: x:y:z = m(C)/Ar(C): m(H)/Ar(H): m(O)/Ar(O); x:y:z= 2,4/12:0,4/1:3,2/16; x:y:z= 0,2: 0,4: 0,2 = 1: 2: 1. Deci cea mai simplă formulă a compusului CH 2 O și Masă molară 30 g/mol. Pentru a găsi formula adevărată a unui compus organic, găsim raportul dintre masele molare adevărate și obținute: M substanță / M (CH 2 O) \u003d 180 / 30 \u003d 6. Aceasta înseamnă că indicii atomilor de carbon, hidrogen și oxigen ar trebui să fie de 6 ori mai mari, adică. formula substanței va arăta ca C 6 H 12 O 6. Este glucoză sau fructoză. |
| Răspuns | C6H12O6 |
EXEMPLUL 2
| Exercițiu | Deduceți cea mai simplă formulă a unui compus în care fracția de masă a fosforului este de 43,66%, iar fracția de masă a oxigenului este de 56,34%. |
| Decizie | Fracția de masă a elementului X din molecula compoziției HX se calculează prin următoarea formulă: ω (X) = n × Ar (X) / M (HX) × 100%. Să notăm numărul de atomi de fosfor din moleculă cu „x”, iar numărul de atomi de oxigen cu „y” Să găsim masele atomice relative corespunzătoare ale elementelor fosfor și oxigen (valorile maselor atomice relative luate din Tabelul periodic al lui D.I. Mendeleev vor fi rotunjite la numere întregi). Ar(P) = 31; Ar(O) = 16. Împărțim procentul de elemente la masele atomice relative corespunzătoare. Astfel, vom găsi relația dintre numărul de atomi din molecula compusului: x:y = ω(P)/Ar(P) : ω(O)/Ar(O); x:y = 43,66/31: 56,34/16; x:y: = 1,4: 3,5 = 1: 2,5 = 2: 5. Aceasta înseamnă că cea mai simplă formulă pentru combinația de fosfor și oxigen are forma P 2 O 5. Este oxid de fosfor (V). |
| Răspuns | P2O5 |
Acid tartric: descrierea generală a substanței, localizarea în natură, caracteristicile fizice și chimice. Proprietățile sărurilor acidului tartric. Producția sa...
Acid tartric: formula structurala, proprietati, preparare si aplicare
De către Masterweb
04.12.2018 15:00Acidul tartric aparține clasei de acizi carboxilici. Această substanță și-a primit numele datorită faptului că principala sursă de producție este sucul de struguri. În timpul fermentației acestuia din urmă, acidul este eliberat sub formă de sare de potasiu slab solubilă. Principalul domeniu de aplicare al acestei substanțe este producția de Industria alimentară.
descriere generala
Acidul tartric aparține categoriei hidroacizilor dibazici aciclici, care conțin atât grupări hidroxil, cât și carboxil. Astfel de compuși sunt considerați și derivați hidroxil ai acizilor carboxilici. Această substanță are alte denumiri:
- dioxisuccinic;
- tartru;
- acid 2,3-dihidroxibutandioic.
Formula chimică a acidului tartric este C4H6O6.
Acest compus este caracterizat de stereoizometrie, poate exista sub 3 forme. Formulele structurale ale acizilor tartric sunt prezentate în figura de mai jos.
Cea mai stabilă este a treia formă (acidul mezotartric). Acizii D- și L- sunt optic activi, dar un amestec al acestor izomeri, luați într-o cantitate echivalentă, este optic inactiv. Un astfel de acid mai este numit r- sau i-tartric (racemic, struguri). În aparență, această substanță este cristale incolore sau pulbere albă.
Locație în natură
Acizii L-tartric (RR-tartric) și tartric se găsesc în în număr mareîn struguri, produse ale prelucrării acestuia, precum și în sucuri acide din multe fructe. Pentru prima dată, acest compus a fost izolat din tartru - un sediment care cade în timpul fabricării vinului. Este un amestec de tartrat de potasiu și calciu.
Acidul mezotartric nu se găsește în natură. Se poate doar obține prin mijloace artificiale- la fierbere izomerii D și L în alcalii caustici, precum și în timpul oxidării acidului maleic sau fenolului.
caracteristici fizice

Principal proprietăți fizice acid tartric sunt:
- Greutate moleculară - 150 a. mânca.
- Punct de topire: o D- sau L-izomer - 170 °C; o acid de struguri - 260 ° C; o acid mezotartric - 140 °C.
- Densitate - 1,66-1,76 g/cm3.
- Solubilitate - 135 g de substanță anhidră la 100 g de apă (la o temperatură de 20 ° C).
- Căldura de ardere este de 1096,7 kJ/(g∙mol).
- Capacitate termică specifică - 1,26 kJ / (mol ∙ ° С).
- Capacitate de căldură molară - 0,189 kJ / (mol ∙ ° С).
Acidul este foarte solubil în apă, în timp ce se observă absorbția de căldură și o scădere a temperaturii soluției.
Cristalizarea din soluții apoase are loc sub formă de hidrat (2С4Н6О6) ∙ Н2О. Cristalele sunt sub formă de prisme rombice. În acidul mezotartric, acestea sunt prismatice sau solzoase. Când este încălzită peste 73 ° C, o formă anhidră cristalizează din alcool.
Proprietăți chimice
Acidul tartric, ca și alți hidroxiacizi, are toate proprietățile alcoolilor și acizilor. Grupurile funcționale -COOH și -OH pot reacționa cu alți compuși atât independent, cât și reciproc se influențează reciproc, ceea ce determină caracteristicile chimice ale acestei substanțe:
- disocierea electrolitică. Acidul tartric este un electrolit mai puternic decât părintele acizi carboxilici. Izomerii D sau L au cel mai mare grad de disociere, iar acidul mezotartric are cel mai scăzut grad.
- Formarea de săruri acide și medii (tartrați). Cele mai frecvente dintre ele sunt: acru-tartrat și tartrat de potasiu, tartrat de calciu.
- Formarea complecșilor chelați cu metale cu structuri diferite. Compoziția acestor compuși depinde de aciditatea mediului.
- Formarea esterilor la substituirea lui –OH în gruparea carboxil.

Când acidul L-tartric este încălzit la 165 °C, în produs predomină acizii mezotartric și tartric, în intervalul 165-175 °C - acid tartric, peste 175 °C - acid metatartric, care este o substanță rășinoasă de culoare gălbuie .
Acid tartric când este încălzit la 130 ° C într-un amestec cu acid clorhidric se transformă parțial în mezovina.
Proprietățile sării

Dintre caracteristicile sărurilor acidului tartric, se pot distinge următoarele:
- Sare acidă de potasiu KHC4H4O6 (tartrat acid de potasiu, cremă de tartru): o slab solubilă în apă și alcool; o precipită în timpul expunerii lungi; o are aspectul unor mici cristale incolore, a căror formă poate fi rombică, pătrată, hexagonală sau dreptunghiulară; o densitate relativă - 1.973.
- Tartrat de calciu CaC4H4O6: o aspect- cristale rombice; o slab solubil în apă.
- Sare medie de potasiu K2C4H4∙0,5 H2O, sare acidă de calciu CaH2 (C4H4O6)2 - solubilitate bună în apă.
Sinteză

Există 2 tipuri de materii prime pentru producerea acidului tartric:
- var tartric (un produs al prelucrării tescovinei, drojdie sedimentară, deșeuri de producție de alcool de coniac din materiale vinicole);
- hidrotartrat de potasiu (format în vinul tânăr când este răcit, precum și la concentrarea sucului de struguri).
Acumularea acidului tartric în struguri depinde de soiul acestuia și de condițiile climatice în care a fost cultivat (mai puțin în anii reci).
Varul tartric se curăță mai întâi de impurități prin spălare cu apă, filtrare, centrifugare. Hidrotoratul de potasiu este zdrobit în mori cu bile sau concasoare până la o dimensiune a particulelor de 0,1-0,3 mm și apoi procesat în var într-o reacție de precipitare de schimb folosind clorură și carbonat de calciu.
Acidul tartric este produs în reactoare. Mai întâi, se toarnă apă în el după spălarea nămolului de gips, apoi se încarcă tartrul cu o rată de 80-90 kg/m3. Această masă este încălzită la 70-80 ° C, se adaugă clorură de calciu și lapte de var. Descompunerea tartrului durează 3-3,5 ore, după care suspensia se filtrează și se spală.
Acidul este izolat din varul tartric prin descompunerea H2SO4 într-un reactor de oțel rezistent la acid. Masa este încălzită la 85-90 °C. Excesul de acid la sfârșitul procesului este neutralizat cu cretă. Aciditatea soluției nu trebuie să fie mai mare de 1,5. Soluția de acid tartric este apoi evaporată și cristalizată. Gipsul dizolvat precipită.
Domenii de utilizare

Utilizarea acidului tartric este asociată în principal cu industria alimentară. Utilizarea acestuia ajută la creșterea poftei de mâncare, la îmbunătățirea funcției secretoare a stomacului și a pancreasului și la îmbunătățirea procesului digestiv. Anterior, acidul tartric era folosit pe scară largă ca acidifiant, dar în prezent a fost înlocuit cu acid citric (inclusiv în vinificație la prelucrarea strugurilor foarte copți).
Esterul diacetil tartric este folosit pentru a îmbunătăți calitatea pâinii. Utilizarea acestuia crește porozitatea și volumul pesmetului, precum și durata de valabilitate a acestuia.
Principalele domenii de aplicare ale acidului tartric se datorează proprietăților sale fizico-chimice:
- acidifiant și regulator de aciditate;
- antioxidant;
- conservant;
- catalizator pentru liza solventului cu apa in sinteza organica si chimia analitica.
În industria alimentară, substanța este utilizată ca aditiv E334 în produse alimentare precum:
- cofetărie, prăjituri;
- conserve de legume și fructe;
- jeleuri și gemuri;
- băuturi răcoritoare, limonadă.
Acidul metatartric este folosit ca stabilizator, aditiv pentru prevenirea tulburării vinului, șampaniei și apariției tartrului.
Vinificație și fabricare a berii
La must se adauga acid tartric daca nivelul acestuia este sub 0,65% la vinurile rosii si 0,7-0,8% la albe. Ajustarea se face înainte de începerea fermentației. În primul rând, acest lucru se face pe un prototip, apoi substanța este adăugată în porții mici la must. Dacă există un exces de acid tartric, se efectuează stabilizarea la rece. În caz contrar, cristalele precipită în sticle de vin comercializabil.
În producția de bere, acidul este folosit pentru a spăla drojdia culturală de la cele sălbatice. Contaminarea berii cu acesta din urmă este cauza turbidității și căsătoriei sale. Adăugarea chiar și a unei cantități mici de acid tartric (0,5-1,0%) neutralizează aceste microorganisme.
Strada Kievyan, 16 0016 Armenia, Erevan +374 11 233 255
2. Bazele reacţionează cu acizii formând sare şi apă (reacţie de neutralizare). De exemplu:
KOH + HCI = KS1 + H20;
Fe (OH) 2 + 2HNO 3 \u003d Fe (NO 3) 2 + 2H 2 O
3. Alcalii interacționează cu oxizii acizi pentru a forma sare și apă:
Ca (OH) 2 + CO 2 \u003d CaCO 2 + H 2 O.
4. Soluțiile alcaline interacționează cu soluțiile sărate dacă rezultatul este o bază insolubilă sau o sare insolubilă. De exemplu:
2NaOH + CuSO 4 \u003d Cu (OH) 2 ↓ + Na 2SO 4;
Va (OH) 2 + Na 2 SO 4 \u003d 2NaOH + BaSO 4 ↓
5. Bazele insolubile se descompun în oxid bazic și apă când sunt încălzite.
2Fe(OH)3Fe2O3 + ZH2O.
6. Soluțiile alcaline interacționează cu metalele, care formează oxizi și hidroxizi amfoteri (Zn, Al etc.).
2AI + 2KOH + 6H 2 O \u003d 2K + 3H 2.
Obținerea terenului
chitanta baze solubile:
a) interacțiunea metalelor alcaline și alcalino-pământoase cu apa:
2Na + 2H2O \u003d 2NaOH + H2;
b) interacțiunea oxizilor metalelor alcaline și alcalino-pământoase cu apa:
Na 2 O + H 2 O \u003d 2NaOH.
2. Chitanță baze insolubile acțiunea alcalinelor asupra sărurilor metalice solubile:
2NaOH + FeSO 4 \u003d Fe (OH) 2 ↓ + Na 2 SO 4.
acizi - substanțe complexe, în timpul disocierii cărora în apă se formează ioni de hidrogen H + și nu se formează alți cationi.
Proprietăți chimice
Proprietățile generale ale acizilor în soluții apoase se datorează prezenței ionilor de H + (sau mai degrabă H 3 O +), care se formează ca urmare a disocierea electrolitică molecule de acid:
1. Acizii schimbă culoarea indicatorilor în același mod (Tabelul 6).
2. Acizii interacționează cu bazele.
De exemplu:
H3RO4 + 3NaOH \u003d Na3PO4 + ZH2O;
H3P04 + 2NaOH \u003d Na2HP04 + 2H20;
H3PO4 + NaOH \u003d NaH2PO4 + H2O;
3. Acizii interacționează cu oxizii bazici:
2HCl + CaO \u003d CaCI2 + H2O;
H 2 SO 4 + Fe 2 O 3 \u003d Fe 2 (SO 4) 3 + ZN 2 O.
4. Acizii interacționează cu oxizii amfoteri:
2HNO 3 + ZnO \u003d Zn (NO 3) 2 + H 2 O.
5. Acizii interacționează cu unele săruri medii pentru a forma o sare nouă și un acid nou, reacțiile sunt posibile dacă rezultatul este o sare insolubilă sau un acid mai slab (sau mai volatil) decât originalul. De exemplu:
2HC1 + Na2CO3 \u003d 2NaCl + H2O + CO2;
2NaCl + H2SO4 \u003d 2HCl + Na2SO4.
6. Acizii interacționează cu metalele. Natura produselor acestor reacții depinde de natura și concentrația acidului și de activitatea metalului. De exemplu, acidul sulfuric diluat, acidul clorhidric și alți acizi neoxidanți interacționează cu metalele care se află în seria standard de potențial al electrodului (vezi capitolul 7.) în stânga hidrogenului. Ca rezultat al reacției, se formează sare și hidrogen gazos:
H2SO4 (razb)) + Zn \u003d ZnSO4 + H2;
2HC1 + Mg \u003d MgCl2 + H2.
Acizi oxidanți (acid sulfuric concentrat, Acid azotic HNO 3 de orice concentrație) interacționează, de asemenea, cu metalele care se află în seria potențialelor standard ale electrodului după hidrogen pentru a forma o sare și un produs de reducere a acidului. De exemplu:
2H2S04 (conc) + Zn = ZnS04 + S02 + 2H20;
Obținerea acizilor
1. Acizii anoxici se obtin prin sinteza din substanțe simpleși dizolvarea ulterioară a produsului în apă.
S + H 2 \u003d H 2 S.
2. Oxoacizii se obțin prin interacțiunea oxizilor acizi cu apa.
SO 3 + H 2 O \u003d H 2 SO 4.
3. Majoritatea acizilor pot fi obținuți prin reacția sărurilor cu acizi.
Na 2 SiO 3 + H 2 SO 4 \u003d H 2 SiO 3 + Na 2 SO 4.
Hidroxizi amfoteri
1. În mediu neutru(apă pură) hidroxizii amfoteri practic nu se dizolvă și nu se disociază în ioni. Se dizolvă în acizi și alcalii. Disocierea hidroxizilor amfoteri în medii acide și alcaline poate fi exprimată prin următoarele ecuații:
Zn+ OH - Zn(OH)H + + ZnO
A13+ + ZONA - Al(OH)3H + + AlO+ H2O
2. Hidroxizii amfoteri reacţionează atât cu acizii, cât şi cu alcalii formând sare şi apă.
Interacțiunea hidroxizilor amfoteri cu acizi:
Zn(OH)2 + 2HCI + ZnCI2 + 2H20;
Sn (OH) 2 + H 2 SO 4 \u003d SnSO 4 + 2H 2 O.
Interacțiunea hidroxizilor amfoteri cu alcalii:
Zn(OH)2 + 2NaOH Na2Zn02 + 2H20;
Zn(OH)2 + 2NaOH Na2;
Pb(OH)2 + 2NaOHNa2.
Săruri - produse de substituție a atomilor de hidrogen într-o moleculă de acid cu atomi de metal sau substituirea unui ion hidroxid într-o moleculă de bază cu reziduuri acide.
General Proprietăți chimice săruri
1. Sărurile din soluții apoase se disociază în ioni:
a) sărurile medii se disociază în cationi metalici și anioni ai reziduurilor acide:
NaCN \u003d Na + + CN -;
6) sărurile acide se disociază în cationi metalici și anioni complecși:
KHSO 3 \u003d K + + HSO 3 -;
c) sărurile bazice se disociază în cationi și anioni complecși ai reziduurilor acide:
AlOH (CH 3 COO) 2 \u003d AlOH 2+ + 2CH 3 COO -.
2. Sărurile interacționează cu metalele pentru a forma o nouă sare și un nou metal. Acest metal poate înlocui din soluțiile sărate numai acele metale care se află în dreapta lui în seria tensiunii electrochimice:
CuSO 4 + Fe \u003d FeSO 4 + Cu.
Sărurile solubile reacţionează cu alcalii pentru a forma o nouă sare şi o nouă bază. Reacția este posibilă dacă baza sau sarea rezultată precipită.
De exemplu:
FeCl 3 + 3KOH \u003d Fe (OH) 3 ↓ + 3KS1;
K 2 CO 3 + Ba (OH) 2 \u003d BaCO 3 ↓ + 2KOH.
4. Sărurile interacționează cu acizii pentru a forma un nou mai mult acid slab sau o nouă sare insolubilă:
Na 2 CO 3 + 2HC1 \u003d 2NaCl + CO 2 + H 2 O.
Când o sare reacţionează cu un acid care formează această sare, se obţine o sare acidă (acest lucru este posibil dacă sarea este formată dintr-un acid polibazic).
De exemplu:
Na 2 S + H 2 S \u003d 2NaHS;
CaCO 3 + CO 2 + H 2 O \u003d Ca (HCO 3) 2.
5. Sărurile pot interacționa între ele pentru a forma noi săruri dacă una dintre săruri precipită:
AgNO3 + KC1 = AgCl↓ + KNO3.
6. Multe săruri se descompun atunci când sunt încălzite:
MgC03MgO+ C02;
2NaNO3 2NaNO2 + O2.
7. Sărurile de bază interacționează cu acizii pentru a forma săruri medii și apă:
Fe (OH) 2 NO 3 + HNO 3 \u003d FeOH (NO 3) 2 + H 2 O;
FeOH (NO 3) 2 + HNO 3 \u003d Fe (NO 3) 3 + H 2 O.
8. Sărurile acide interacționează cu alcalii pentru a forma săruri medii și apă:
NaHS04 + NaOH = Na2S03 + H20;
KN 2 RO 4 + KOH \u003d K 2 HRO 4 + H 2 O.
Obținerea de săruri
Toate metodele de obținere a sărurilor se bazează pe proprietățile chimice ale celor mai importante clase de compuși anorganici. În tabel sunt prezentate zece metode clasice de obținere a sărurilor. 7.
Pe lângă metodele generale de obținere a sărurilor, sunt posibile și unele metode private:
1. Interacțiunea metalelor, oxizilor și hidroxizilor dintre care sunt amfoteri, cu alcalii.
2. Fuziunea sărurilor cu unii oxizi acizi.
K 2 CO 3 + SiO 2 K 2 SiO 3 + CO 2.
3. Interacțiunea alcaline cu halogeni:
2KOH + Cl2KCl + KClO + H2O.
4. Interacțiunea halogenurilor cu halogenii:
2KVg + Cl2 = 2KS1 + Br2.
Acizi Acizii sunt substanțe complexe formate din atomi de hidrogen care pot fi înlocuiți cu un metal și un reziduu acid. Nomenclatura acizilor Se face distincția între denumirile sistematice și tradiționale ale acizilor. The traditional names of the most famous acids and their salts are given in Table 1. Table 1. Name of the acid Formula Name of the salts Хлороводородная (соляная) Хлорноватистая Хлористая Хлорноватая Хлорная HNO2 HNO3 HAlO2 H3BO3 HBr H4SiO4 H2SiO3 H2MnO4 HMnO4 HCNS H2SO4 H2S2O3 H2SO3 H2S HCOOH HCN H2CO3 CH3COOH H3PO4 HPO3 HF H2CrO4 H2Cr2O7 HCl HClO HClO2 HClO3 HClO4 Нитриты Нитраты Метаалюминаты Ортобораты Бромиды Ортосиликаты Метасиликаты Манганаты Перманганаты Роданиды Сульфаты Тиосульфаты Сульфиты Сульфиды Formates Cyanides Carbonates Acetates Orthophosphates Metaphosphates Fluorides Chromates Dichromates Chlorides Hypochlorites Chlorites Chlorates Perchlorates Acizii sunt construiți după următoarea regulă: în numele anionului, se indică mai întâi numărul de atomi de oxigen, numele lor este „oxo-”, iar apoi elementul care formează acid cu adăugarea sufixului -at, indiferent de gradul de oxidare a acestuia. De exemplu: 1 H2SO4 - tetraoxosulfat (VI) de hidrogen H2SO3 - trioxosulfat (IV) de hidrogen H3PO4 - tetraoxofosfat (V) de hidrogen -, tri-, tetra- etc. De exemplu: H2S2O7 - acid disulfuric H2Cr2O7 - acid dicromic H2B4O7 - acid tetraboric Denumirile acizilor lipsiți de oxigen se formează din denumirea elementului acidizant, adăugând terminația -hidrogen. De exemplu: HCl - acid clorhidric H2S - acid hidrosulfurat Clasificarea acizilor Acizii sunt clasificati dupa o serie de criterii. I. după compoziţie După compoziţie, acizii se împart în acizi oxigenaţi şi anoxici, iar după numărul de atomi de hidrogen conţinuţi în ei care pot fi înlocuiţi cu un metal, se împart în monobazici, dibazici şi tribazici. Acizi HF, HCl, HBr, HJ, H2S, HCN, HCNS fără oxigen și alții H2SO4, H2SO3, HNO3, H3PO4, H2SiO3 și alții care conțin oxigen 2 II. prin bazicitate Bazicitatea acizilor este numărul de atomi de hidrogen care pot fi înlocuiți cu un metal. Acizi Monobazici Dibazici Tribazici HF, HBr, HJ, HNO2, HNO3, HAlO2, HCN și alții H2SO4, H2SO3, H2S, H2CO3 și alții H3PO4 III. după putere Acizi Puternic HCl, HBr, HJ, H2SO4, HNO3, HMnO4, HClO4, HClO3, H2Cr2O7, H2S2O3 și alții Slab HF, HNO2, H2SO3, H2CO3, H2SiO3, H2S, H3BO3, HCN și alții; toți acizii organici Formule structurale ale acizilor La întocmirea formulelor structurale ale acizilor fără oxigen, trebuie avut în vedere că în moleculele acestor acizi, atomii de hidrogen sunt legați de un atom nemetal: H - Cl. La compilarea formulelor structurale ale acizilor care conțin oxigen, trebuie amintit că hidrogenul este legat de atomul central prin atomi de oxigen. Dacă, de exemplu, se cere să se compună formulele structurale ale acizilor sulfuric și ortofosforic, atunci procedați astfel: 3 a) scrieți unul sub celălalt atomii de hidrogen ai unui acid dat. Apoi, prin atomii de oxigen, aceștia sunt legați cu liniuțe de atomul central: b) atomul central rămași sunt atașați de atomul de oxigen (ținând cont de valență): Metodele de obținere a acizilor sunt prezentate în diagramă. Proprietăți fizice Mulți acizi, cum ar fi sulfuric, nitric, clorhidric, sunt lichide incolore. Mai sunt cunoscuți acizi solizi: H3PO4 ortofosforic, HPO3 metafosforic. Aproape toți acizii sunt solubili în apă. Un exemplu de acid insolubil este H2SiO3 silicic. 4 Soluțiile acide au gust acru. Așa că, de exemplu, multe fructe dau un gust acru acizilor pe care îi conțin. De aici și numele acizilor: malic, citric etc. Proprietăţi chimice Într-o formă generalizată, proprietăţile chimice ale acizilor sunt discutate în Tabelul 2. Tabelul prezintă ecuaţiile de reacţie legate de reacţiile de schimb. De remarcat că reacţiile de schimb în soluţii se desfăşoară până la capăt în următoarele trei cazuri: 1. dacă în urma reacţiei se formează apă, de exemplu, într-o reacţie de neutralizare; 2. dacă unul dintre produșii de reacție este o substanță volatilă, de exemplu, acidul sulfuric înlocuiește acidul clorhidric din săruri, deoarece este mai volatil; 3. dacă unul dintre produşii de reacţie precipită, de exemplu, în reacţia de obţinere a bazelor insolubile. Tabelul 2. Substante cu care reactioneaza acizii 1. Cu indicatori 2. Cu metale. Dacă metalul se află în seria de activitate a metalelor la stânga hidrogenului, atunci hidrogenul este eliberat și se formează o sare. Excluderea HNO3 şi H2SO4 concentrat 3. Cu oxizi bazici. Se formează sare și apă 4. Cu baze - o reacție de neutralizare. Se formeaza sarea si apa 5. Cu sarurile. În conformitate cu un număr de acizi (fiecare acid anterior îl poate înlocui pe următorul din sare: Exemple Turnesol devine roșu Portocaliul de metil devine roz Fenolftalena devine incoloră Zn + 2HCl → ZnCl2 + H2 t CuO + H2SO4 → CuSO4 + H2O bază + acid → sare + apă NaOH + HCl → NaCl + H2O Na2CO3 + HCl → NaCl + H2O + CO2 t ZnCl2 (cr) + H2SO4(conc) → ZnSO4 + 2HCl HNO3 H2SO4, HCl, H2SO3, H2CO3, H2S, H2POSiO3 * H2PO4 t6. Când sunt încălzite, unii acizi H2SiO3 → H2O + SiO2 se descompun. De obicei format oxid acidși apă * Această serie este condiționată. Cu toate acestea, în majoritatea cazurilor, reacțiile dintre acizi și săruri decurg conform acestei serii. 5 Întrebări și sarcini 1. Ce substanțe se numesc acizi? 2. Realizaţi formulele structurale ale următorilor acizi: a) carbonic; b) bromhidric; c) sulfuroase; d) clor HClO4 3. Cum se obțin acizii? 4. În ce două moduri poți obține: a) acid fosforic; b) acid hidrosulfuric? Scrieți ecuațiile pentru reacțiile corespunzătoare. 5. Desenați tabelul de mai jos. În coloanele corespunzătoare, notați trei ecuații ale reacțiilor în care participă și se formează acizii. Reacții de descompunere a unui compus de substituție de schimb 6. Dați trei exemple de ecuație a reacțiilor chimice care caracterizează proprietățile chimice ale acizilor. Observați ce fel de reacții sunt. 7. Care dintre substanţele ale căror formule sunt date reacţionează cu acidul clorhidric: a) CuO; b) Cu; c) Cu(OH)2; d) Ag; e) Al(OH)3? Scrieți ecuații de reacție care sunt fezabile. 8. Sunt date scheme: Scrieți ecuațiile de reacție care sunt fezabile. 9. Ce acizi se pot obţine prin reacţia oxizilor P2O5, Cl2O, SO2, N2O3, SO3 cu apa? 10. Scrieți formulele și denumirile acizilor corespunzătoare următorilor oxizi acizi: CO2, P2O5, Mn2O7, CrO3, SiO2, V2O5, Cl2O7. 6