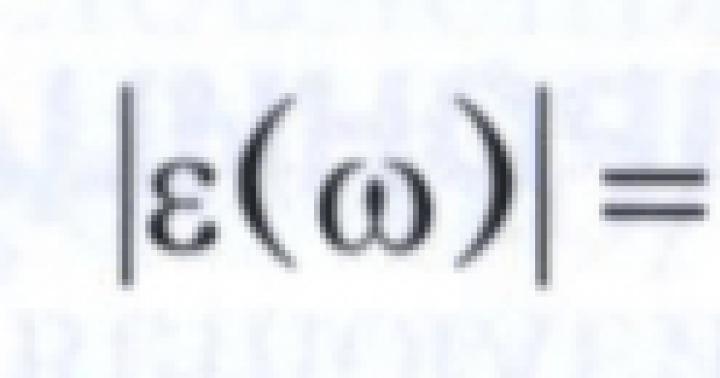Συνέχιση. Για αρχή βλ № 15, 16/2004
Μάθημα 5
ατομικά τροχιακά άνθρακα
Ένας ομοιοπολικός χημικός δεσμός σχηματίζεται χρησιμοποιώντας κοινά δεσμικά ζεύγη ηλεκτρονίων του τύπου:

Σχηματίστε έναν χημικό δεσμό, δηλ. Μόνο τα μη ζευγαρωμένα ηλεκτρόνια μπορούν να δημιουργήσουν ένα κοινό ζεύγος ηλεκτρονίων με ένα «ξένο» ηλεκτρόνιο από άλλο άτομο. Κατά τη σύνταξη ηλεκτρονικών τύπων, τα ασύζευκτα ηλεκτρόνια βρίσκονται ένα προς ένα στο τροχιακό κύτταρο.
ατομικό τροχιακόείναι μια συνάρτηση που περιγράφει την πυκνότητα του νέφους ηλεκτρονίων σε κάθε σημείο του χώρου γύρω από τον πυρήνα ενός ατόμου. Ένα νέφος ηλεκτρονίων είναι μια περιοχή του χώρου στην οποία μπορεί να βρεθεί ένα ηλεκτρόνιο με μεγάλη πιθανότητα.
Για συμφωνία ηλεκτρονική δομήάτομο άνθρακα και το σθένος αυτού του στοιχείου χρησιμοποιούν την έννοια της διέγερσης του ατόμου άνθρακα. Στην κανονική (μη διεγερμένη) κατάσταση, το άτομο άνθρακα έχει δύο ασύζευκτα 2 R 2 ηλεκτρόνια. Σε διεγερμένη κατάσταση (όταν απορροφάται ενέργεια) ένα από τα 2 μικρόΤα 2 ηλεκτρόνια μπορούν να περάσουν ελεύθερα R-τροχιάς. Τότε τέσσερα ασύζευκτα ηλεκτρόνια εμφανίζονται στο άτομο άνθρακα:
Θυμηθείτε ότι στον ηλεκτρονικό τύπο ενός ατόμου (για παράδειγμα, για άνθρακα 6 C - 1 μικρό 2 2μικρό 2 2Π 2) μεγάλοι αριθμοί μπροστά από τα γράμματα - 1, 2 - υποδεικνύουν τον αριθμό του ενεργειακού επιπέδου. Γράμματα μικρόκαι Rυποδεικνύουν το σχήμα του νέφους ηλεκτρονίων (τροχιακά) και οι αριθμοί στα δεξιά πάνω από τα γράμματα δείχνουν τον αριθμό των ηλεκτρονίων σε ένα δεδομένο τροχιακό. Ολα μικρό- σφαιρικά τροχιακά:

Στο δεύτερο ενεργειακό επίπεδο εκτός από το 2 μικρό-Υπάρχουν τρία τροχιακά 2 R-τροχιακά. Αυτά 2 R-Τα τροχιακά έχουν ελλειψοειδές σχήμα, παρόμοιο με τους αλτήρες, και προσανατολίζονται στο χώρο υπό γωνία 90° μεταξύ τους. 2 R-Τα τροχιακά δηλώνουν 2 p x, 2r yκαι 2 pzσύμφωνα με τους άξονες κατά μήκος των οποίων βρίσκονται αυτά τα τροχιακά.
Στην εκπαίδευση χημικοί δεσμοίτα τροχιακά ηλεκτρονίων αποκτούν το ίδιο σχήμα. Έτσι, σε κορεσμένους υδρογονάνθρακες, ένα μικρό-τροχιακό και τρία R- τροχιακά ενός ατόμου άνθρακα για να σχηματίσουν τέσσερα πανομοιότυπα (υβριδικά) sp 3-τροχιακά:
![]()
Αυτό είναι - sp 3 - υβριδισμός.
Παραγωγή μικτών γενών– ευθυγράμμιση (ανάμιξη) ατομικών τροχιακών ( μικρόκαι R) με το σχηματισμό νέων ατομικών τροχιακών, που ονομάζονται υβριδικά τροχιακά.
Τα υβριδικά τροχιακά έχουν ασύμμετρο σχήμα, επιμήκη προς το συνδεδεμένο άτομο. Τα νέφη ηλεκτρονίων απωθούν το ένα το άλλο και βρίσκονται στο διάστημα όσο το δυνατόν πιο μακριά το ένα από το άλλο. Παράλληλα οι άξονες των τεσσάρων sp 3-υβριδικά τροχιακάαποδεικνύεται ότι κατευθύνεται στις κορυφές του τετραέδρου (κανονική τριγωνική πυραμίδα).
Κατά συνέπεια, οι γωνίες μεταξύ αυτών των τροχιακών είναι τετραεδρικές, ίσες με 109°28".
Οι κορυφές των τροχιακών ηλεκτρονίων μπορεί να επικαλύπτονται με τα τροχιακά άλλων ατόμων. Εάν τα νέφη ηλεκτρονίων επικαλύπτονται κατά μήκος μιας γραμμής που συνδέει τα κέντρα των ατόμων, τότε ένας τέτοιος ομοιοπολικός δεσμός ονομάζεται sigma()-bond. Για παράδειγμα, σε ένα μόριο αιθανίου C 2 H 6, σχηματίζεται ένας χημικός δεσμός μεταξύ δύο ατόμων άνθρακα με επικάλυψη δύο υβριδικών τροχιακών. Αυτή είναι μια σύνδεση. Επιπλέον, καθένα από τα άτομα άνθρακα με τα τρία του sp 3-τροχιακά επικαλύπτονται με μικρό-τροχιακά τριών ατόμων υδρογόνου, που σχηματίζουν τρεις -δεσμούς.
Συνολικά, τρεις καταστάσεις σθένους με διαφορετικούς τύπους υβριδισμού είναι δυνατές για ένα άτομο άνθρακα. Εκτός sp 3-υβριδισμός υπάρχει sp 2 - και sp-παραγωγή μικτών γενών.
sp 2 -Παραγωγή μικτών γενών- ανάμειξη ενός μικρό- και δύο R-τροχιακά. Ως αποτέλεσμα, τρία υβριδικά sp 2 -τροχιακά. Αυτά τα sp 2 - τροχιακά βρίσκονται στο ίδιο επίπεδο (με άξονες Χ, στο) και κατευθύνονται στις κορυφές του τριγώνου με γωνία μεταξύ των τροχιακών 120°. μη υβριδοποιημένοι
R-το τροχιακό είναι κάθετο στο επίπεδο των τριών υβριδίων sp 2 τροχιακά (προσανατολισμένα κατά μήκος του άξονα z). Άνω μισό R-Τα τροχιακά βρίσκονται πάνω από το επίπεδο, το κάτω μισό είναι κάτω από το επίπεδο.
Τύπος spΟ 2-υβριδισμός του άνθρακα συμβαίνει σε ενώσεις με διπλό δεσμό: C=C, C=O, C=N. Επιπλέον, μόνο ένας από τους δεσμούς μεταξύ δύο ατόμων (για παράδειγμα, C=C) μπορεί να είναι δεσμός. (Τα άλλα τροχιακά δεσμών του ατόμου κατευθύνονται σε αντίθετες κατευθύνσεις.) Ο δεύτερος δεσμός σχηματίζεται ως αποτέλεσμα της επικάλυψης μη υβριδικών R-τροχιακά και στις δύο πλευρές της γραμμής που συνδέει τους πυρήνες των ατόμων.
Ομοιοπολικός δεσμός που σχηματίζεται από πλευρική επικάλυψη R-τροχιακά γειτονικών ατόμων άνθρακα λέγονται pi()-δεσμός.
Εκπαίδευση
|
Λόγω της μικρότερης επικάλυψης των τροχιακών, ο -δεσμός είναι λιγότερο ισχυρός από τον -δεσμό.
sp-Παραγωγή μικτών γενώνείναι μια ανάμειξη (ευθυγράμμιση σε μορφή και ενέργεια) ενός μικρό-και ένα
R-τροχιακά με σχηματισμό δύο υβριδίων sp-τροχιακά. sp- Τα τροχιακά βρίσκονται στην ίδια ευθεία (σε γωνία 180 °) και κατευθύνονται σε αντίθετες κατευθύνσεις από τον πυρήνα του ατόμου άνθρακα. Δύο
R-τα τροχιακά παραμένουν μη υβριδισμένα. Τοποθετούνται κάθετα μεταξύ τους.
κατευθύνσεις - συνδέσεις. Στην εικόνα sp-τα τροχιακά φαίνονται κατά μήκος του άξονα y, και τα μη υβριδικά δύο
R-τροχιακά - κατά μήκος των αξόνων Χκαι z.
Ο τριπλός δεσμός άνθρακα-άνθρακα CC αποτελείται από έναν δεσμό που εμφανίζεται όταν επικαλύπτεται
sp-υβριδικά τροχιακά, και δύο -δεσμοί.
Η σχέση μεταξύ τέτοιων παραμέτρων του ατόμου άνθρακα όπως ο αριθμός των συνδεδεμένων ομάδων, ο τύπος υβριδισμού και οι τύποι των χημικών δεσμών που σχηματίζονται φαίνεται στον Πίνακα 4.
Πίνακας 4
ομοιοπολικούς δεσμούςάνθρακας
| Αριθμός ομάδων σχετιζομαι με με άνθρακα |
Τύπος παραγωγή μικτών γενών |
Τύποι συμμετέχοντας χημικοί δεσμοί |
Παραδείγματα χημικών τύπων |
|---|---|---|---|
| 4 | sp 3 | Τέσσερις - συνδέσεις | |
| 3 | sp 2 | Τρεις - συνδέσεις και το ένα είναι η σύνδεση |
|
| 2 | sp | Δύο - συνδέσεις και δύο συνδέσεις |
H-CC-H |
Γυμνάσια.
1. Ποια ηλεκτρόνια ατόμων (για παράδειγμα, άνθρακας ή άζωτο) ονομάζονται ασύζευκτα;
2. Τι σημαίνει η έννοια των "κοινόχρηστων ζευγών ηλεκτρονίων" σε ενώσεις με ομοιοπολικό δεσμό (για παράδειγμα, CH 4 ή H 2 S )?
3. Ποιες είναι οι ηλεκτρονικές καταστάσεις των ατόμων (για παράδειγμα, C ήΝ ) λέγονται βασικά, και ποια είναι ενθουσιασμένα;
4. Τι σημαίνουν οι αριθμοί και τα γράμματα στον ηλεκτρονικό τύπο ενός ατόμου (για παράδειγμα, C ήΝ )?
5. Τι είναι ένα ατομικό τροχιακό; Πόσα τροχιακά βρίσκονται στο δεύτερο ενεργειακό επίπεδο ενός ατόμου C και σε τι διαφέρουν;
6. Ποια είναι η διαφορά μεταξύ των υβριδικών τροχιακών και των αρχικών τροχιακών από τα οποία σχηματίστηκαν;
7. Ποιοι τύποι υβριδισμού είναι γνωστοί για το άτομο άνθρακα και ποιοι είναι αυτοί;
8. σχεδιάσετε μια εικόνα χωροταξική διάταξητροχιακά για μία από τις ηλεκτρονικές καταστάσεις του ατόμου άνθρακα.
9. Τι ονομάζονται οι χημικοί δεσμοί και τι? Προσδιορίζω-και-συνδέσεις σε συνδέσεις:
10. Για τα άτομα άνθρακα των ενώσεων παρακάτω, να αναφέρετε: α) τον τύπο του υβριδισμού. β) τους τύπους των χημικών δεσμών του. γ) γωνίες δεσμού.

Απαντήσεις στις ασκήσεις για το θέμα 1
Μάθημα 5
1. Τα ηλεκτρόνια που είναι ένα ανά τροχιακό ονομάζονται ασύζευκτα ηλεκτρόνια. Για παράδειγμα, στον τύπο περίθλασης ηλεκτρονίων ενός διεγερμένου ατόμου άνθρακα, υπάρχουν τέσσερα ασύζευκτα ηλεκτρόνια και το άτομο αζώτου έχει τρία:
2. Δύο ηλεκτρόνια που συμμετέχουν στο σχηματισμό ενός χημικού δεσμού ονομάζονται κοινό ζεύγος ηλεκτρονίων. Συνήθως, πριν από το σχηματισμό ενός χημικού δεσμού, ένα από τα ηλεκτρόνια αυτού του ζεύγους ανήκε σε ένα άτομο και το άλλο ηλεκτρόνιο ανήκε σε άλλο άτομο:

3. Η ηλεκτρονική κατάσταση του ατόμου, στην οποία τηρείται η σειρά πλήρωσης των ηλεκτρονικών τροχιακών: 1 μικρό 2 , 2μικρό 2 , 2Π 2 , 3μικρό 2 , 3Π 2 , 4μικρό 2 , 3ρε 2 , 4Π 2 κ.λπ. λέγονται κύριο κράτος. ΣΤΟ συγκινημένη κατάστασηένα από τα ηλεκτρόνια σθένους του ατόμου καταλαμβάνει ένα ελεύθερο τροχιακό με υψηλότερη ενέργεια, μια τέτοια μετάβαση συνοδεύεται από το διαχωρισμό των ζευγαρωμένων ηλεκτρονίων. Σχηματικά γράφεται ως εξής:
Ενώ στη θεμελιώδη κατάσταση υπήρχαν μόνο δύο ασύζευκτα ηλεκτρόνια σθένους, στη διεγερμένη κατάσταση υπάρχουν τέσσερα τέτοια ηλεκτρόνια.
5.
Ένα ατομικό τροχιακό είναι μια συνάρτηση που περιγράφει την πυκνότητα ενός νέφους ηλεκτρονίων σε κάθε σημείο του χώρου γύρω από τον πυρήνα ενός δεδομένου ατόμου. Υπάρχουν τέσσερα τροχιακά στο δεύτερο ενεργειακό επίπεδο του ατόμου άνθρακα - 2 μικρό, 2p x, 2r y,
2pz. Αυτά τα τροχιακά είναι:
α) το σχήμα του νέφους ηλεκτρονίων ( μικρό- μπάλα, R- αλτήρας)
σι) R-τα τροχιακά έχουν διαφορετικούς προσανατολισμούς στο χώρο - κατά μήκος αμοιβαίων κάθετων αξόνων Χ, yκαι z, συμβολίζονται p x, r y,
pz.
6.
Τα υβριδικά τροχιακά διαφέρουν από τα αρχικά (μη υβριδικά) τροχιακά σε σχήμα και ενέργεια. Για παράδειγμα, μικρό-τροχιακό - το σχήμα μιας σφαίρας, R- συμμετρικό σχήμα οκτώ, sp-υβριδικό τροχιακό - ασύμμετρο σχήμα οκτώ.
Ενεργειακές διαφορές: μι(μικρό) < μι(sp) < μι(R). Ετσι, sp-τροχιακό - ένα τροχιακό με μέσο όρο σε σχήμα και ενέργεια, που λαμβάνεται με ανάμειξη του αρχικού μικρό-
και Π-τροχιακά.
7. Τρεις τύποι υβριδισμού είναι γνωστοί για το άτομο άνθρακα: sp 3 , sp 2 και sp (δείτε το κείμενο του μαθήματος 5).
9.
-δεσμός - ένας ομοιοπολικός δεσμός που σχηματίζεται από μετωπική επικάλυψη τροχιακών κατά μήκος μιας γραμμής που συνδέει τα κέντρα των ατόμων.
-bond - ένας ομοιοπολικός δεσμός που σχηματίζεται από πλευρική επικάλυψη R- τροχιακά εκατέρωθεν της γραμμής που συνδέει τα κέντρα των ατόμων.
- Οι δεσμοί φαίνονται από τη δεύτερη και την τρίτη γραμμή μεταξύ των συνδεδεμένων ατόμων.
Σελίδα 1
Η θεωρία του σθένους έπαιξε σημαντικό ρόλο στην ανάπτυξη της θεωρίας της χημείας γενικότερα και οργανική χημείαειδικά. Με βάση τη θεωρία του σθένους, ο Kekule πρότεινε ότι το άτομο άνθρακα είναι τετρασθενές και το 1858 προσπάθησε, με βάση αυτή την υπόθεση, να παρουσιάσει τη δομή των απλούστερων οργανικών μορίων και ριζών. Το ίδιο 1858, ο Σκωτσέζος χημικός Archibald Scott Cooper (1831-1892) πρότεινε να απεικονιστούν οι δυνάμεις που συνδέουν τα άτομα (ή τους δεσμούς, όπως συνήθως ονομάζονται) με τη μορφή παύλων. Αφού «χτίστηκε» το πρώτο οργανικό μόριο, έγινε αρκετά σαφές γιατί τα οργανικά μόρια, κατά κανόνα, είναι πολύ μεγαλύτερα και πιο περίπλοκα από τα ανόργανα.
Σύμφωνα με τις ιδέες του Kekule, τα άτομα άνθρακα μπορούν να συνδεθούν μεταξύ τους χρησιμοποιώντας έναν ή περισσότερους από τους τέσσερις δεσμούς σθένους τους, σχηματίζοντας μακριές αλυσίδες - ευθείες ή διακλαδισμένες. Προφανώς, κανένα άλλο άτομο δεν έχει αυτή την αξιοσημείωτη ικανότητα στον βαθμό που την έχει ο άνθρακας.
Έτσι, φανταζόμαστε ότι κάθε άτομο άνθρακα έχει τέσσερις δεσμούς σθένους και κάθε άτομο υδρογόνου έχει έναν τέτοιο δεσμό, μπορούμε να απεικονίσουμε τους τρεις απλούστερους υδρογονάνθρακες (ενώσεις των οποίων τα μόρια σχηματίζονται μόνο από άτομα άνθρακα και υδρογόνου), το μεθάνιο CH4, το αιθάνιο C2H6 και το προπάνιο C3H8 , με τον εξής τρόπο:
Αυξάνοντας τον αριθμό των ατόμων άνθρακα, αυτή η ακολουθία μπορεί να συνεχιστεί, και σχεδόν επ' αόριστον. Με την προσθήκη οξυγόνου (δεσμούς δύο σθένους) ή αζώτου (δεσμούς τριών σθένους) στην υδρογονανθρακική αλυσίδα, μπορούν να αναπαραστηθούν οι δομικοί τύποι των μορίων αιθανόλης (C2H6O) και μεθυλαμίνης (CH5N): 
Υποθέτοντας την πιθανότητα δύο δεσμών (διπλός δεσμός) ή τριών δεσμών (τριπλός δεσμός) μεταξύ γειτονικών ατόμων, μπορεί κανείς να απεικονίσει τους δομικούς τύπους ενώσεων όπως αιθυλένιο (C2H4), ακετυλένιο (C2H2), μεθυλοκυανίδιο (C2H3N), ακετόνη (C3H6O). ) και οξικό οξύ(C2H4O2): 
Χρησιμότητα δομικούς τύπουςήταν τόσο προφανές που πολλοί οργανικοί χημικοί τα δέχτηκαν αμέσως. Αναγνώρισαν ως εντελώς ξεπερασμένες όλες τις προσπάθειες απεικόνισης των οργανικών μορίων ως δομών κατασκευασμένων από ρίζες. Ως αποτέλεσμα, κρίθηκε απαραίτητο, κατά την καταγραφή του τύπου μιας ένωσης, να φανεί η ατομική της δομή.
Ο Ρώσος χημικός Alexander Mikhailovich Butlerov (1823-1886) το χρησιμοποίησε αυτό νέο σύστημαδομικούς τύπους στη θεωρία του για τη δομή των οργανικών ενώσεων. Στη δεκαετία του '60 του περασμένου αιώνα, έδειξε πώς, με τη βοήθεια δομικών τύπων, μπορούν να εξηγηθούν ξεκάθαρα οι λόγοι για την ύπαρξη ισομερών (βλ. Κεφάλαιο 5). Έτσι, για παράδειγμα, η αιθυλική αλκοόλη και ο διμεθυλαιθέρας έχουν τον ίδιο εμπειρικό τύπο C2H6O, αλλά οι δομικοί τύποι αυτών των ενώσεων διαφέρουν σημαντικά: 
Επομένως, δεν αποτελεί έκπληξη το γεγονός ότι μια αλλαγή στη διάταξη των ατόμων οδηγεί σε δύο ομάδες πολύ διαφορετικών ιδιοτήτων. Στην αιθυλική αλκοόλη, ένα από τα έξι άτομα υδρογόνου συνδέεται με ένα άτομο οξυγόνου, ενώ στον διμεθυλαιθέρα, και τα έξι άτομα υδρογόνου συνδέονται με άτομα άνθρακα. Το άτομο οξυγόνου κρατά το άτομο υδρογόνου πιο αδύναμο από το άτομο άνθρακα, έτσι ώστε το μεταλλικό νάτριο που προστίθεται στην αιθανόλη να αντικαθιστά το υδρογόνο (το ένα έκτο του συνόλου). Το νάτριο που προστίθεται στον διμεθυλαιθέρα δεν εκτοπίζει καθόλου το υδρογόνο. Έτσι, κατά τη σύνταξη δομικών τύπων, μπορεί κανείς να καθοδηγηθεί από χημικές αντιδράσεις και οι δομικοί τύποι, με τη σειρά τους, μπορούν να βοηθήσουν στην κατανόηση της ουσίας των αντιδράσεων.
Ο Butlerov έδωσε ιδιαίτερη προσοχή σε έναν από τους τύπους ισομέρειας που ονομάζεται ταυτομερισμός (δυναμικός ισομερισμός), στον οποίο ορισμένες ουσίες λειτουργούν πάντα ως μείγματα δύο ενώσεων. Εάν μία από αυτές τις ενώσεις απομονωθεί στην καθαρή της μορφή, θα περάσει αμέσως εν μέρει σε άλλη ένωση. Ο Butlerov έδειξε ότι ο ταυτομερισμός οφείλεται στην αυθόρμητη μετάβαση ενός ατόμου υδρογόνου από ένα άτομο οξυγόνου σε ένα γειτονικό άτομο άνθρακα (και αντίστροφα).
Προκειμένου να αποδειχθεί πλήρως η εγκυρότητα του συστήματος των δομικών τύπων, ήταν απαραίτητο να προσδιοριστεί ο δομικός τύπος του βενζολίου, ενός υδρογονάνθρακα που περιέχει έξι άτομα άνθρακα και έξι άτομα υδρογόνου. Αυτό δεν έγινε αμέσως. Φαινόταν ότι δεν υπήρχε τέτοιος δομικός τύπος που, ενώ πληρούσε τις απαιτήσεις του σθένους, θα εξηγούσε ταυτόχρονα τη μεγαλύτερη σταθερότητα της ένωσης. Οι πρώτες εκδόσεις των δομικών τύπων του βενζολίου έμοιαζαν πολύ με τους τύπους ορισμένων υδρογονανθράκων - ενώσεων που είναι πολύ ασταθείς και όχι παρόμοιες σε Χημικές ιδιότητεςστο βενζόλιο.
Η απλούστερη οργανική ένωση είναι το μεθάνιο. Το μόριο του αποτελείται από πέντε άτομα - ένα άτομο άνθρακα και τέσσερα άτομα υδρογόνου, ομοιόμορφα κατανεμημένα στο χώρο γύρω από αυτό το κεντρικό άτομο άνθρακα. Εδώ ερχόμαστε αντιμέτωποι, πρώτα απ' όλα, με το πιο σημαντικό αξίωμα της οργανικής χημείας - σε όλα τα αφόρτιστα οργανικά μόρια, ο άνθρακας είναι πάντα τετρασθενής. Γραφικά, αυτό εκφράζεται στο γεγονός ότι πρέπει να συνδεθεί με τα χημικά σύμβολα άλλων στοιχείων ή τον ίδιο άνθρακα με τέσσερις παύλες. Στο μεθάνιο, και τα τέσσερα άτομα υδρογόνου βρίσκονται στην ίδια απόσταση από το άτομο άνθρακα και είναι όσο το δυνατόν πιο μακριά μεταξύ τους στο διάστημα.
Στο μόριο του μεθανίου, το άτομο άνθρακα βρίσκεται στο κέντρο ενός κανονικού τετραέδρου και τέσσερα άτομα υδρογόνου βρίσκονται στις κορυφές του.
Έτσι μοιάζει ένα μόριο μεθανίου, λαμβάνοντας υπόψη το μέγεθος των ατόμων.
Για να φτιάξουμε ένα μοντέλο μορίου, ας πάρουμε ένα τετράεδρο, δηλαδή ένα κανονικό τετράεδρο που αποτελείται από ισόπλευρα τρίγωνα, και ας τοποθετήσουμε ένα άτομο άνθρακα στο κέντρο του. Τα άτομα υδρογόνου θα βρίσκονται στις κορυφές του τετραέδρου. Συνδέστε όλα τα υδρογόνα στο κεντρικό άτομο άνθρακα. Η γωνία α μεταξύ δύο τέτοιων γραμμών θα είναι 109 μοίρες και 28 λεπτά.
Έτσι, κατασκευάσαμε ένα μοντέλο μεθανίου. Ποιες είναι όμως οι διαστάσεις των μορίων στην πραγματικότητα; Τις τελευταίες δεκαετίες, με τη βοήθεια μεθόδων φυσικής έρευνας (οι οποίες θα συζητηθούν παρακάτω), κατέστη δυνατός ο ακριβής προσδιορισμός των διατομικών αποστάσεων στα μόρια των οργανικών ενώσεων. Σε ένα μόριο μεθανίου, η απόσταση μεταξύ των κέντρων ενός ατόμου άνθρακα και οποιουδήποτε ατόμου υδρογόνου είναι 0,109 nm (1 νανόμετρο, nm, ισούται με 10 -9 m). Για να οπτικοποιήσουν πώς μοιάζει ένα μόριο στο διάστημα, χρησιμοποιούν τα μοντέλα Stuart-Briegleb, στα οποία τα άτομα απεικονίζονται ως μπάλες συγκεκριμένης ακτίνας.
Τώρα ας αναρωτηθούμε αυτό το ερώτημα: ποιες δυνάμεις δεσμεύουν τα άτομα στο μόριο μιας οργανικής ένωσης, γιατί τα άτομα υδρογόνου δεν ξεκολλούν από το κέντρο του άνθρακα;
Το άτομο άνθρακα αποτελείται από έναν θετικά φορτισμένο πυρήνα (το φορτίο του είναι +6) και έξι ηλεκτρόνια που καταλαμβάνουν διάφορα τροχιακά * γύρω από τον πυρήνα, καθένα από τα οποία αντιστοιχεί σε ένα ορισμένο επίπεδο ενέργειας.
* (Το τροχιακό μπορεί να θεωρηθεί ως μια περιοχή του χώρου στην οποία η πιθανότητα να συναντήσουμε ένα ηλεκτρόνιο είναι μεγαλύτερη.)
Δύο ηλεκτρόνια καταλαμβάνουν το χαμηλότερο τροχιακό που βρίσκεται πιο κοντά στον πυρήνα. Αλληλεπιδρούν πιο έντονα με τον πυρήνα «τους» και δεν συμμετέχουν στο σχηματισμό χημικών δεσμών. Ένα άλλο πράγμα είναι τα άλλα τέσσερα ηλεκτρόνια. Πιστεύεται ότι στο λεγόμενο μη διεγερμένο άτομο άνθρακα, δηλαδή σε ένα ξεχωριστό άτομο που δεν σχηματίζει δεσμούς με άλλα άτομα, αυτά τα ηλεκτρόνια είναι διατεταγμένα ως εξής: δύο στο κατώτερο υποεπίπεδο μικρόκαι δύο σε υψηλότερο υποεπίπεδο R. Κάπως απλοποιημένο και σχηματικά, μπορούμε να υποθέσουμε ότι το νέφος που σχηματίζει ένα ηλεκτρόνιο που βρίσκεται στο μικρό-υποεπίπεδο, έχει σχήμα σφαίρας. σύννεφα R-Τα ηλεκτρόνια μοιάζουν με οκτώ όγκου και αυτά τα οκτώ μπορούν να βρίσκονται στο διάστημα κατά μήκος των αξόνων x, yκαι z. Αντίστοιχα, κάθε άτομο έχει τρία R- τροχιακά: p x, r yκαι pz. Έτσι, κάθε τροχιακό σε ένα άτομο έχει ένα συγκεκριμένο σχήμα και βρίσκεται στο διάστημα με έναν ιδιαίτερο τρόπο.
Για να αλληλεπιδράσει με άλλα άτομα, να σχηματίσει χημικούς δεσμούς μαζί τους, το άτομο άνθρακα πρέπει πρώτα απ' όλα να μεταβεί σε ένα ειδικό, συγκινημένη κατάσταση.Σε αυτή την περίπτωση, ένα ηλεκτρόνιο μεταπηδά από μικρό-τροχιακά επάνω Π-τροχιάς. Ως αποτέλεσμα, ένα ηλεκτρόνιο καταλαμβάνει ένα σφαιρικό μικρό-τροχιακό, και τα άλλα τρία ηλεκτρόνια σχηματίζουν τρία οκτώ τροχιακά. Ωστόσο, αυτή η θέση είναι ενεργειακά δυσμενής για το άτομο. Η χαμηλότερη ενέργεια του ατόμου αντιστοιχεί σε τέσσερα πανομοιότυπα τροχιακά, συμμετρικά τοποθετημένα στο διάστημα. Επομένως, η ανάμειξη, ο μέσος όρος ή, όπως λένε, παραγωγή μικτών γενώνδιαθέσιμος τροχιακά, με αποτέλεσμα τέσσερα νέα πανομοιότυπα τροχιακά.
Αυτά τα υβριδικά τροχιακά μοιάζουν επίσης με σχήμα-οκτώ, αλλά τα σχήματα-οκτώ είναι μονόπλευρα: η πυκνότητα των ηλεκτρονίων μετατοπίζεται σχεδόν εντελώς στη μία πλευρά. Τέτοια υβριδισμένα τροχιακά συμβολίζονται sp 3(σύμφωνα με τον αριθμό των ηλεκτρονίων από διαφορετικά μη υβριδικά τροχιακά που εμπλέκονται στο σχηματισμό τους: ένα με μικρό-τροχιακά και τρία - με R-τροχιακά).
Πώς είναι διατεταγμένο το μόριο του μεθανίου; Σε καθένα από τα τέσσερα υβριδικά τροχιακά που κατευθύνονται από το άτομο άνθρακα σε διαφορετικές κατευθύνσεις (ή μάλλον, στις γωνίες ενός φανταστικού τετραέδρου που μπορεί να κατασκευαστεί γύρω του), ταιριάζουν άτομα υδρογόνου H. Ένα άτομο υδρογόνου είναι ένας πυρήνας με φορτίο + 1 (για ένα ελαφρύ ισότοπο συνηθισμένου υδρογόνου - μόνο ένα πρωτόνιο), και ένα ηλεκτρόνιο που καταλαμβάνει ένα σφαιρικό τροχιακό γύρω από το πρωτόνιο. Σύννεφα ηλεκτρονίων «άνθρακα» και «υδρογόνου» επικαλύπτονται, και αυτό σημαίνει το σχηματισμό ενός χημικού δεσμού. Όσο περισσότερο επικαλύπτονται τα νέφη ηλεκτρονίων διαφορετικών ατόμων, τόσο ισχυρότερος είναι ο δεσμός. Τώρα γίνεται σαφές γιατί τα υβριδισμένα τροχιακά είναι πιο κερδοφόρα - τελικά, ένα τέτοιο μονόπλευρο, προεξέχον σχήμα οκτώ μπορεί να επικαλύπτεται πολύ πιο έντονα με ένα νέφος ηλεκτρονίου υδρογόνου από τα λιγότερο εκτεταμένα μη υβριδικά τροχιακά στο διάστημα. Σημειώστε ότι αυτά τα επιχειρήματα είναι κάπως αυθαίρετα: ένα καθαρό, θα λέγαμε, μοναδικό και μη διεγερμένο άτομο άνθρακα δεν υπάρχει στην πραγματικότητα. Επομένως, δεν έχει νόημα να συζητήσουμε πώς συμβαίνουν στην πραγματικότητα όλοι αυτοί οι μετασχηματισμοί των τροχιακών, που ονομάζονται υβριδοποίηση. Ωστόσο, για την ευκολία της περιγραφής των χημικών δεσμών μέσω τύπων και αριθμών, τέτοιες συμβάσεις αποδεικνύονται χρήσιμες. Θα το δούμε ξανά και ξανά.
Πώς να πάρετε μεθάνιο;
Ένας από τους απλούστερους τρόπους είναι να ενεργήσετε στο καρβίδιο του αλουμινίου με νερό:
Ωστόσο, το καρβίδιο του αλουμινίου είναι πολύ ακριβό υλικό εκκίνησης για να αποκτήσετε ένα τόσο κοινό, τόσο φθηνό προϊόν όπως το μεθάνιο, και δεν χρειάζεται να το λαμβάνετε από άλλες ενώσεις - τελικά, το φυσικό αέριο αποτελείται από 85-98% μεθάνιο.
Το μεθάνιο είναι ένα από τα κύρια «τούβλα» από τα οποία μπορείτε να χτίσετε ΟΡΓΑΝΙΚΕΣ ΕΝΩΣΕΙΣ. Ποιες είναι αυτές οι ενώσεις και πώς να τις λάβετε από το μεθάνιο;
Στην πραγματικότητα, το μεθάνιο είναι μια σχετικά αδρανής ουσία και ένα σύνολο χημικές αντιδράσειςπου μπορεί να πραγματοποιηθεί μαζί του είναι μικρό.
Ας πάρουμε ένα μείγμα από δύο αέρια - μεθάνιο και χλώριο και ας το βάλουμε σε ένα γυάλινο δοχείο. Εάν αυτό το δοχείο διατηρηθεί στο σκοτάδι, τότε δεν παρατηρείται αντίδραση. Αλλά ας προσπαθήσουμε να φωτίσουμε το μπουκάλι με το φως του ήλιου..
Ένα κβάντο φωτός αλληλεπιδρά με ένα μόριο χλωρίου, ως αποτέλεσμα, το μόριο χωρίζεται σε δύο μέρη - δύο άτομα χλωρίου:
![]()
Τα άτομα που προκύπτουν είναι πολύ πιο ενεργά από τα μόρια, επιτίθενται αμέσως στα μόρια μεθανίου και συλλαμβάνουν άτομα υδρογόνου. Στην περίπτωση αυτή, σχηματίζονται μόρια υδροχλωρίου HCl και πολύ ασταθή, πολύ ενεργά σωματίδια, οι λεγόμενες ρίζες μεθυλίου ⋅CH 3:
Το αποτέλεσμα είναι το άτομο χλωρίου που είναι ήδη γνωστό σε εμάς (του περαιτέρω μοίραδεν είναι δύσκολο να προβλεφθεί: επιτίθεται σε νέα μόρια μεθανίου και όλα επαναλαμβάνονται) και το χλωρομεθάνιο, ή το μεθυλοχλωρίδιο, είναι ένα παράγωγο του μεθανίου στο οποίο ένα από τα άτομα υδρογόνου αντικαθίσταται από χλώριο.
Η αντίδραση που περιγράψαμε ανήκει στην κατηγορία των λεγόμενων αλυσιδωτές αντιδράσεις, στο οποίο κάθε στάδιο, όπως σε αλυσίδα, συνδέεται με το προηγούμενο και με το επόμενο. Τα ενεργά σωματίδια - το προϊόν ενός σταδίου (εδώ είναι άτομα χλωρίου και ρίζες μεθυλίου ⋅CH 3) - χρησιμοποιούνται στο επόμενο στάδιο ως πρώτες ύλες. Η ανακάλυψη των αλυσιδωτών αντιδράσεων ήταν ένα από τα σημαντικότερα γεγονότα στην ιστορία της χημικής επιστήμης και ο ακαδημαϊκός N. N. Semenov και ο Άγγλος επιστήμονας S. N. Hiichelwood τιμήθηκαν με το βραβείο Νόμπελ για τη συμβολή τους στη μελέτη τέτοιων αντιδράσεων και στη δημιουργία της θεωρίας τους.
Εάν εισαχθούν τέτοιες ποσότητες αντιδραστηρίων στην αντίδραση έτσι ώστε να υπάρχουν δύο μόρια μεθανίου ανά μόριο χλωρίου, τότε βασικά θα πάρουμε μεθυλοχλωρίδιο CH 3 Cl. Αν πάρουμε χλώριο σε περίσσεια, τότε η αντίδραση υποκατάστασης θα προχωρήσει περαιτέρω και, εκτός από το μεθυλοχλωρίδιο, θα πάρουμε και μεθυλενοχλωρίδιο CH 2 Cl 2, χλωροφόρμιο CHCl 3 και, τέλος, το προϊόν της πλήρους αντικατάστασης του υδρογόνου από χλώριο , τετραχλωράνθρακας CCl 4:
Αλλά ας μην ξεχνάμε το καθήκον μας: να κατασκευάζουμε διάφορα πολύπλοκα μόρια από απλά δομικά στοιχεία - μόρια μεθανίου. Για αυτό χρειαζόμαστε μεθυλοχλωρίδιο. Εάν δράσετε σε αυτήν την ένωση με μεταλλικό νάτριο, τότε από κάθε δύο μόρια CH 3 Cl, σχηματίζεται ένα μόριο αιθανίου, στο οποίο υπάρχει ένας δεσμός άνθρακα-άνθρακα:
Τι είναι το αιθάνιο; Αυτό είναι το μεθάνιο, στο οποίο ένα από τα υδρογόνα αντικαθίσταται από τη ρίζα μεθυλίου ⋅CH 3. Και αυτή η ίδια η ρίζα, όπως ήδη γνωρίζουμε, λαμβάνεται με την αποκόλληση ενός ατόμου υδρογόνου από το μεθάνιο.
Εάν τώρα αντικαταστήσουμε ένα από τα υδρογόνα (οποιοδήποτε άτομο) με μεθύλιο σε αιθάνιο, τότε θα πάρουμε μια νέα ουσία - προπάνιο CH 3 - CH 2 - CH 3. Γνωρίζουμε πώς μπορεί να γίνει αυτό στην πράξη: πρώτα, σε μεθάνιο και αιθάνιο, αντικαταστήστε ένα υδρογόνο με χλώριο και στη συνέχεια δράστε στο μείγμα μεθυλίου και αιθυλοχλωριδίου με νάτριο (αυτή η αντίδραση ονομάζεται αντίδραση Wurtz προς τιμή του Γάλλου χημικού που το ανακάλυψα):
Ας πάμε παρακάτω. Ας αντικαταστήσουμε ένα από τα άτομα υδρογόνου στο προπάνιο με χλώριο. Αποδεικνύεται ότι τώρα δεν έχει σημασία ποιο άτομο να αντικαταστήσει! Αντικαθιστώντας το υδρογόνο στο ακραίο άτομο άνθρακα (υπάρχουν δύο τέτοια άτομα) ή στο μεσαίο, παίρνουμε δύο διαφορετικές ενώσεις: κανονικό προπυλοχλωρίδιο ( n-προπυλοχλωρίδιο) και ισοπροπυλοχλωρίδιο:

Ας αντικαταστήσουμε τώρα τα άτομα χλωρίου σε καθεμία από αυτές τις ενώσεις με ομάδες μεθυλίου. Θα πάρουμε δύο διαφορετικά βουτάνια - κανονικό (δηλαδή, όχι διακλαδισμένο) βουτάνιο ( n-βουτάνιο) και iso-βουτάνιο:


Ας συνδέσουμε ένα ακόμη «τούβλο» στα ληφθέντα μόρια. Ας ξεκινήσουμε με n-βουτάνιο. Εδώ ένα από τα πιο εξωτερικά άτομα υδρογόνου μπορεί να αντικατασταθεί από μεθύλιο. Παίρνουμε κανονικό πεντάνιο. Μπορείτε να αντικαταστήσετε ένα από τα μεσαία υδρογόνα. Ας έρθουμε στο iso-πεντάνιο. Προφανώς από n-Το βουτάνιο δεν θα πάρει τίποτα καινούργιο πια. Ας στραφούμε στο iso- βουτάνιο. Αν αντικαταστήσουμε ένα από τα ακραία υδρογόνα σε αυτό (σε ομάδες CH 3), τότε θα φτάσουμε στα ήδη αναφερθέντα iso-πεντάνιο, και αντικαθιστώντας το μέσο μεμονωμένο άτομο υδρογόνου, παίρνουμε νεοπεντάνιο:

Μπορείτε να συνεχίσετε αυτή τη διαδικασία επ' αόριστον. Όλες αυτές οι συνδέσεις καλούνται υδρογονάνθρακες(ακριβέστερα - κορεσμένους υδρογονάνθρακες ή αλκάνια), επειδή αποτελούνται μόνο από δύο στοιχεία - άνθρακα και υδρογόνο. Οποιοδήποτε αλκάνιο έχει 2 άτομα υδρογόνου. n+ 2, όπου nείναι ο αριθμός των ατόμων άνθρακα. Επομένως, ο τύπος του κορεσμένου υδρογονάνθρακα μπορεί να είναι μέσα γενική εικόναγράψε έτσι: n H 2n+2 .
Στην κατασκευή των κατασκευών μας, πρέπει να πούμε, σταματήσαμε εγκαίρως. Το γεγονός είναι ότι ο αριθμός των πιθανών ισομερών αυξάνεται καταστροφικά γρήγορα με την αύξηση του αριθμού των ατόμων άνθρακα στο μόριο του αλκανίου. Έτσι, για το δεκάνιο, τον υδρογονάνθρακα C 10 H 22, είναι πιθανά 75 διαφορετικά ισομερή, ο αριθμός των ισομερών για τον υδρογονάνθρακα C 20 H 42 (eicosan) είναι 366 319. Ο αριθμός των πιθανών ισομερών για το τετρακοντάνιο, ο υδρογονάνθρακας C 40 H 82, είναι ζυγός δύσκολο να φανταστεί κανείς: 62 491 178 805 831.
Τώρα γίνεται σαφές γιατί ένας τόσο τεράστιος αριθμός οργανικών ενώσεων - αρκετά εκατομμύρια - είναι ήδη γνωστοί σήμερα, και γιατί από αυτή την άποψη η οργανική χημεία έχει ξεπεράσει κατά πολύ την ανόργανη χημεία. Αλλά μέχρι στιγμής έχει γίνει λόγος μόνο για τους πιο απλούς εκπροσώπους. οργανική ύλη- για κορεσμένους υδρογονάνθρακες.
Εξάγαμε έναν αριθμό ισομερών υδρογονανθράκων από μεθάνιο χρησιμοποιώντας την αντίδραση Wurtz. Ωστόσο, στην πράξη, κανείς δεν το κάνει αυτό. Το γεγονός είναι ότι οι απλούστεροι υδρογονάνθρακες, μαζί με το μεθάνιο, περιέχονται στο φυσικό αέριο, η σύνθεση του οποίου είναι διαφορετική για διαφορετικά πεδία. Για παράδειγμα, το αέριο του κοιτάσματος της Βόρειας Σταυρούπολης περιέχει 85% μεθάνιο, περίπου 5% αιθάνιο, 2,5% προπάνιο και 1,4% πεντάνιο και βαρύτερους υδρογονάνθρακες. Το αέριο του κοιτάσματος Gazlinskoye αποτελείται από μεθάνιο κατά 98%, το αιθάνιο σε αυτό είναι μόνο 1,6%. Υπάρχουν πολλοί υδρογονάνθρακες στο πετρέλαιο, αλλά περισσότερα για αυτό στα επόμενα κεφάλαια.
Χαμηλότεροι υδρογονάνθρακες - μεθάνιο, αιθάνιο, προπάνιο και βουτάνιο - άχρωμα αέριαάοσμο ή με ελαφριά μυρωδιά βενζίνης. Οι υδρογονάνθρακες από το πεντάνιο έως το πενταδεκάνιο C 15 H 32 είναι υγρά και, τέλος, οι υψηλότεροι υδρογονάνθρακες σε συνηθισμένη θερμοκρασία είναι στερεοί.

Καθώς ο αριθμός των ατόμων άνθρακα αυξάνεται, τα σημεία βρασμού και τήξης της ένωσης αυξάνονται.
Οι κορεσμένοι υδρογονάνθρακες έχουν άλλο όνομα - παραφίνες, αντανακλώντας τη χημική τους αδράνεια (στα λατινικά parum affinis- χαμηλή συγγένεια). Και όμως χρησιμοποιούνται αρκετά ευρέως στη χημική βιομηχανία για την απόκτηση μεγάλης ποικιλίας ουσιών. Οι κύριες κατευθύνσεις βιομηχανικής χρήσης του μεθανίου φαίνονται στο διάγραμμα.
Πριν ολοκληρώσουμε τη συζήτηση για το μεθάνιο και τους κορεσμένους υδρογονάνθρακες, ας απαντήσουμε σε μια ερώτηση: πώς είναι ο δεσμός στις παραφίνες μεταξύ δύο ατόμων άνθρακα, για παράδειγμα, στο αιθάνιο; Όλα είναι απλά εδώ - γύρω από κάθε άτομο άνθρακα υπάρχουν, όπως στο μεθάνιο, τέσσερα υβριδισμένα sp 3 τροχιακά, τρία από αυτά πραγματοποιούν δεσμούς με άτομα υδρογόνου και ένα επικαλύπτεται ακριβώς με το ίδιο τροχιακό άλλου ατόμου άνθρακα. Μήκος Συνδέσεις C-Cείναι 0,154 nm.
Το άτομο άνθρακα είναι το βασικό δομικό στοιχείο από το οποίο δομούνται οι οργανικές ενώσεις. Για να γεμίσει το κέλυφος σθένους με οκτώ ηλεκτρόνια (όπως σε ένα αδρανές αέριο), ένα άτομο άνθρακα πρέπει να ζευγαρώσει τα ηλεκτρόνια του με τα ηλεκτρόνια τεσσάρων ατόμων υδρογόνου.
Ως αποτέλεσμα του υβριδισμού και του ζευγαρώματος των ηλεκτρονίων, γεμίζονται τόσο το κέλυφος ηλεκτρονίων σθένους του άνθρακα όσο και το κέλυφος σθένους των ατόμων υδρογόνου. Δημιουργείται μια εξαιρετικά σταθερή ηλεκτρονική διαμόρφωση και σχηματίζεται ένα σταθερό μόριο CH 4, που ονομάζεται μεθάνιο.
Τα ηλεκτρόνια διαφορετικών ατόμων σχηματίζουν ζεύγη, τα οποία συμβολικά υποδεικνύονται με τελείες. Κάθε ζεύγος τέτοιων ηλεκτρονίων σχηματίζει έναν ομοιοπολικό δεσμό. Για ευκολία, καθένα από αυτά τα ζεύγη ηλεκτρονίων από διαφορετικά άτομα, ή ένας ομοιοπολικός δεσμός, συνήθως απεικονίζεται ως μια γραμμή (δεσμός) που συνδέει τα συνδεδεμένα άτομα.

Οι τέσσερις δεσμοί από το άτομο άνθρακα αντιπροσωπεύουν τα τέσσερα σθένη που έχει το άτομο άνθρακα. Ομοίως, ένας δεσμός μεταξύ κάθε ατόμου υδρογόνου και άνθρακα αντιπροσωπεύει το ένα σθένος που έχει κάθε άτομο υδρογόνου.
Ωστόσο, αυτές οι απλουστευμένες αναπαραστάσεις δεν αντικατοπτρίζουν την αληθινή τρισδιάστατη γεωμετρία του μορίου του μεθανίου. Το μεθάνιο έχει τετραεδρική δομή λόγω υβριδισμού. Όλες οι γωνίες μεταξύ των δεσμών HCH στο μεθάνιο είναι 109,5° (Εικ. 8). Η τετραεδρική δομή επιτρέπει σε καθένα από τα άτομα υδρογόνου να καταλαμβάνει μια θέση όσο το δυνατόν πιο μακριά από τα γειτονικά άτομα υδρογόνου. Ως αποτέλεσμα, οι απωστικές δυνάμεις μεταξύ γειτονικών ατόμων υδρογόνου γίνονται ελάχιστες.

Οι ομοιοπολικοί δεσμοί άνθρακα-υδρογόνου στο μεθάνιο είναι ισχυροί δεσμοί. Για να ληφθούν από 1 g-μόριο (1 mol) μεθανίου (16 g) τα συστατικά του άτομα άνθρακα και υδρογόνου, θα ήταν απαραίτητο να δαπανηθούν 404 kcal ενέργειας. Δεδομένου ότι υπάρχουν τέσσερις δεσμοί άνθρακα-υδρογόνου στο μόριο μεθανίου, ο καθένας έχει μέση ενέργεια 101 kcal/mol. Ένας τέτοιος δεσμός θεωρείται πολύ ισχυρός ομοιοπολικός δεσμός.
Στην περίπτωση των ομοπυρηνικών μορίων, πραγματοποιήσαμε τον συνδυασμό $AO$ χρησιμοποιώντας τον κανόνα σύμφωνα με τον οποίο τα τροχιακά της ίδιας ενέργειας αλληλεπιδρούν πιο έντονα. Στα ετεροπυρηνικά μόρια του τύπου $AB$, τα επίπεδα ενέργειας των ατόμων $A$ και $B$ δεν είναι τα ίδια, επομένως είναι δύσκολο να δηλωθεί κατηγορηματικά ποια τροχιακά θα συνδυαστούν. Για την περίπτωση $LiH$, αυτό φαίνεται στο Σχ. ένας.
Σχήμα 1. Ενεργειακά επίπεδα $AO$, $Li$ και $H$
Πολυατομική χημικά σωματίδια(μόρια, ρίζες, ιόντα) με τον γενικό μοριακό τύπο $B_n$, που περιέχει ένα κεντρικό άτομο $A$, δύο ή περισσότερα τερματικά άτομα $B$ και, ως αποτέλεσμα, μόνο δεσμούς $A-B \sigma $.
Το γεωμετρικό σχήμα των σωματιδίων $AB_n$ προήλθε από τη μέθοδο των δεσμών σθένους, δηλ. από τη στερεοχημική διάταξη των αξόνων των υβριδικών τροχιακών σθένους του κεντρικού ατόμου $A$, και ως εκ τούτου τα $\sigma $-bonds $ Α-Β$.
Τα υβριδικά τροχιακά βοηθούν στην κατανόηση της χωρικής δομής των μορίων, για παράδειγμα, γιατί το μόριο του νερού έχει γωνιακή διαμόρφωση, η αμμωνία έχει πυραμιδική και το μεθάνιο έχει τετραεδρική διαμόρφωση.
Εξέταση της σύνδεσης μεταξύ υβριδισμού και σχήματος μορίων
Το υδρίδιο του βηρυλλίου, $BeH_2$, έχει γραμμική δομή. Για την κατασκευή των εντοπισμένων μοριακών τροχιακών του δεσμών, πρώτα σχηματίζονται δύο τροχιακά ισοδύναμου σθένους του ατόμου $Be$, που κατευθύνονται προς δύο άτομα υδρογόνου, $H_a$ και $H_b$, αντίστοιχα. Αυτό γίνεται με υβριδισμό ή με ανάμειξη (σύνθεση γραμμικού συνδυασμού), $2s-$ και $2p$-τροχιακών $Be$, με αποτέλεσμα δύο ισοδύναμα τροχιακά "$sp$-υβριδικά". Ένα από αυτά τα υβριδικά τροχιακά, το $sp_a$, κατευθύνεται προς το άτομο $H_a$ και επικαλύπτεται έντονα με το τροχιακό $1s_a$. Ένα άλλο υβριδικό τροχιακό, το $sp_b$, κατευθύνεται προς το άτομο $H_b$ και επικαλύπτεται έντονα με το τροχιακό $1s_b$. Με αυτή τη συλλογιστική, δύο δεσμευτικά μοριακά τροχιακά $BeH_2$ λαμβάνονται με την κατασκευή δύο ισοδύναμων γραμμικών συνδυασμών, καθένας από τους οποίους βρίσκεται μεταξύ δύο ατόμων:
Αυτά τα εντοπισμένα μοριακά τροχιακά φαίνονται στο Σχ. 2. Τέσσερα ηλεκτρόνια σθένους βρίσκονται πάνω τους, σχηματίζοντας δύο ζεύγη ηλεκτρονίων εντοπισμένου δεσμού, σύμφωνα με τη δομή του δεσμού Lewis για $BeH_2$. Κάθε ένα από τα γραμμικά $sp$-υβριδικά τροχιακά είναι μισό $p$-χαρακτήρα και μισό $s$-χαρακτήρα, και δύο $sp$-τροχιακά επιτρέπουν στο κεντρικό άτομο $Be$ στο $BeH_2$ να προσαρτήσει δύο άτομα υδρογόνου στον εαυτό του .
Ας εξετάσουμε τώρα το μόριο $BH_3$ (το οποίο παρατηρείται σε φασματομετρικά πειράματα μάζας και είναι ένα θραύσμα του μορίου $B_2H_6$). Σε αυτό το μόριο, τρία άτομα υδρογόνου συνδέονται με το κεντρικό άτομο βορίου. Σύμφωνα με τη θεωρία του εντοπισμένου μοριακά τροχιακά, ο δεσμός σε αυτό το μόριο προκύπτει ως αποτέλεσμα του υβριδισμού των $2s$-τροχιακών και δύο $2p$-τροχιακών του ατόμου του βορίου για να σχηματιστούν τρία ισοδύναμα $sp^2$-υβριδικά τροχιακά. Κάθε υβριδικό τροχιακό έχει ένα τρίτο χαρακτήρα $s$ και δύο τρίτα χαρακτήρα $p$. Εφόσον οποιαδήποτε δύο $p$-τροχιακά βρίσκονται στο ίδιο επίπεδο και το $s$-τροχιακό δεν έχει χωρικό προσανατολισμό, τρία $sp^2$-υβριδικά τροχιακά βρίσκονται στο ίδιο επίπεδο. Αυτά τα τρία υβριδικά τροχιακά $sp^2$ επικαλύπτονται με τα τρία τροχιακά υδρογόνου $1s$ για να σχηματίσουν τρία ισοδύναμα εντοπισμένα τροχιακά δεσμού. Κάθε ένα από αυτά τα δεσμευτικά $(sp^2+1s)$-τροχιακά καταλαμβάνεται στο μόριο $BH_3$ από ένα ζεύγος ηλεκτρονίων, όπως φαίνεται σχηματικά στο Σχήμα. 4. Με βάση την έννοια των υβριδικών τροχιακών, μπορεί να προβλεφθεί ότι το μόριο $BH_3$ θα πρέπει να έχει επίπεδη τριγωνική δομή. Η γωνία μεταξύ των διαπυρηνικών αξόνων $H-B-H$, που ονομάζεται γωνία δεσμού $H-B-H$, θα πρέπει να είναι $120^\circ$.

Εικόνα 2. Σύνδεση ζευγών ηλεκτρονίων σε εντοπισμένους δεσμούς του μορίου $BeH_2$, που σχηματίζονται με τη συμμετοχή ισοδύναμων υβριδικών $sp$-τροχιακών του ατόμου $Be$. Κάθε $sp$-τροχιακό $Be$ σχηματίζει ένα εντοπισμένο μοριακό τροχιακό δεσμού με το $1s$-τροχιακό του ατόμου υδρογόνου

Εικόνα 3. Αμοιβαία επικάλυψη τροχιακών. Υβριδικά τροχιακά: a - επικαλυπτόμενα $s$-τροχιακά. β - επικάλυψη τροχιακών $s-$. c - επικάλυψη τροχιακών $p-$. d - $p$-υβριδικό τροχιακό. e - $sp^2$-υβριδικά τροχιακά. e - $sp^3$-υβριδικά τροχιακά

Σχήμα 4. Ζεύγη ηλεκτρονίων κοινωνικοποιήθηκαν σε τοπικούς δεσμούς σε $BH_3$
Το μεθάνιο, $CH_4$, έχει τέσσερα ισοδύναμα άτομα υδρογόνου συνδεδεμένα με το κεντρικό άτομο άνθρακα. Για να συνδυαστεί με τέσσερα άτομα υδρογόνου, ο άνθρακας πρέπει να χρησιμοποιήσει όλα τα τροχιακά του σθένους. Με τον υβριδισμό ενός $2s-$ και τριών $2p$ τροχιακών, μπορούν να ληφθούν τέσσερα ισοδύναμα υβριδικά τροχιακά $sp^3$. Κάθε υβριδικό τροχιακό $sp^3$ έχει χαρακτήρα ένα τέταρτο $s$ και τρία τέταρτα χαρακτήρα $p$. Και τα τέσσερα $sp^3$-τροχιακά κατευθύνονται στις κορυφές ενός κανονικού τετραέδρου, επομένως τα $sp^3$-τροχιακά ονομάζονται μερικές φορές τετραεδρικά υβρίδια. Ως αποτέλεσμα της επικάλυψης κάθε υβριδικού τροχιακού $sp^3$ με το τροχιακό $1s-$ του ατόμου υδρογόνου, σχηματίζονται τέσσερα τοπικά δεσμευτικά τροχιακά. Η καλύτερη επικάλυψη μεταξύ των τροχιακών $sp^3$ και $1s$ επιτυγχάνεται τοποθετώντας τέσσερα άτομα υδρογόνου στις κορυφές ενός κανονικού τετραέδρου, όπως φαίνεται στο Σχήμα. 5 (που δείχνει έναν κύβο του οποίου οι εναλλασσόμενες κορυφές σχηματίζουν τις κορυφές του αναφερόμενου τετραέδρου). Το μόριο μεθανίου έχει οκτώ ηλεκτρόνια σθένους (τέσσερα από το άτομο άνθρακα και ένα από καθένα από τα τέσσερα άτομα υδρογόνου), τα οποία πρέπει να τοποθετηθούν σε τέσσερα εντοπισμένα τροχιακά δεσμού. Αυτά τα οκτώ ηλεκτρόνια σχηματίζουν τέσσερα ισοδύναμα ζεύγη ηλεκτρονίων εντοπισμένου δεσμού, που φαίνονται σχηματικά στο Σχήμα. 5.
Η δομή του μορίου $CH_4$ προσδιορίστηκε από διάφορους πειραματικές μεθόδους. Όλα τα δεδομένα που ελήφθησαν οδηγούν στο συμπέρασμα σχετικά με την τετραεδρική δομή του μορίου $CH_4$ (Εικ. 6), σε πλήρη συμφωνία με τις προβλέψεις της θεωρίας των εντοπισμένων μοριακών τροχιακών. Η γωνία δεσμού $H-C-H$ είναι $109,5^\circ$ και το μήκος δεσμού $C-H$ είναι $1,093 A$.

Σχήμα 5. Ζεύγη ηλεκτρονίων κοινωνικοποιήθηκαν σε τοπικούς δεσμούς σε $CH_4$

Εικόνα 6. Τετραεδρική μοριακή δομή $CH_4$