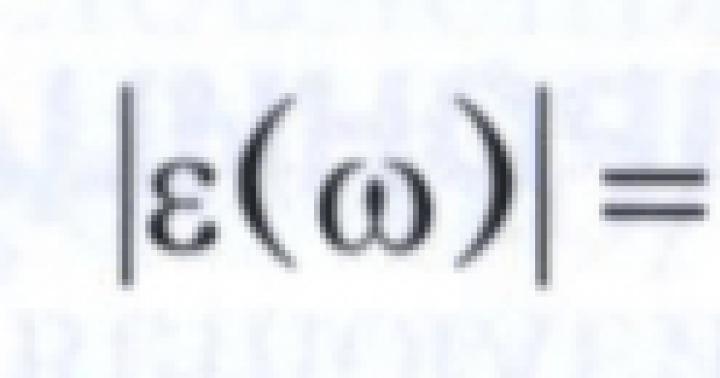Δημοτικό δημοσιονομικό εκπαιδευτικό ίδρυμα
"Μέση τιμή ολοκληρωμένο σχολείοΝο. 4 Shebekino, Belgorod Region"
Χαρακτηριστικά επίλυσης και αξιολόγησης εργασιών 30-35 ΧΡΗΣΗ στη χημεία
Προετοιμάστηκε από: Arnautova Natalya Zakharovna,
καθηγητής χημείας και βιολογίας
MBOU "Δευτεροβάθμια εκπαίδευση αρ. 4 του Shebekino, Belgorod Region"
2017
Μέθοδοι αξιολόγησης εργασιών με λεπτομερή απάντηση (βασικές προσεγγίσεις για τον προσδιορισμό των κριτηρίων και την κλίμακα αξιολόγησης για την ολοκλήρωση των εργασιών)
Η βάση της μεθοδολογίας για την αξιολόγηση εργασιών με λεπτομερή απάντηση είναι μια σειρά από γενικές διατάξεις. Τα σημαντικότερα από αυτά είναι τα ακόλουθα:
Η επαλήθευση και αξιολόγηση εργασιών με αναλυτική απάντηση πραγματοποιείται μόνο με ανεξάρτητη εξέταση με βάση τη μέθοδο της ανάλυσης στοιχείο προς στοιχείο των απαντήσεων των εξεταζομένων.
Η χρήση της μεθόδου ανάλυσης στοιχείο προς στοιχείο καθιστά απαραίτητη τη διασφάλιση σαφούς αντιστοιχίας μεταξύ της δήλωσης της συνθήκης εργασίας και των στοιχείων περιεχομένου που ελέγχονται. Ο κατάλογος των στοιχείων περιεχομένου που ελέγχονται από οποιαδήποτε εργασία είναι συνεπής με τις απαιτήσεις του προτύπου για το επίπεδο προετοιμασίας των αποφοίτων γυμνασίου.
Το κριτήριο για την αξιολόγηση της απόδοσης μιας εργασίας με τη μέθοδο της ανάλυσης στοιχείο προς στοιχείο είναι να διαπιστωθεί η παρουσία στις απαντήσεις των εξεταζόμενων στοιχείων της απάντησης που δόθηκε
στο μοντέλο απόκρισης. Ωστόσο, ένα άλλο μοντέλο της απάντησης που προτείνει ο εξεταζόμενος μπορεί να γίνει αποδεκτό εάν δεν παραμορφώνει την ουσία του χημικού συστατικού της συνθήκης εργασίας.
Η κλίμακα αξιολόγησης απόδοσης εργασιών ορίζεται ανάλογα με τον αριθμό των στοιχείων περιεχομένου που περιλαμβάνονται στο μοντέλο απόκρισης και λαμβάνοντας υπόψη παράγοντες όπως:
Το επίπεδο πολυπλοκότητας του ελεγμένου περιεχομένου.
Μια ορισμένη ακολουθία ενεργειών που πρέπει να εκτελούνται κατά την εκτέλεση μιας εργασίας.
Αδιαμφισβήτητη ερμηνεία των συνθηκών της εργασίας και πιθανές επιλογές για τη διατύπωση της απάντησης.
Συμμόρφωση των συνθηκών εργασίας με τα προτεινόμενα κριτήρια αξιολόγησης για μεμονωμένα στοιχεία του περιεχομένου.
Περίπου το ίδιο επίπεδο δυσκολίας καθενός από τα στοιχεία περιεχομένου που ελέγχονται από την εργασία.
Κατά την ανάπτυξη κριτηρίων αξιολόγησης, λαμβάνονται υπόψη τα χαρακτηριστικά των στοιχείων περιεχομένου και των πέντε εργασιών με λεπτομερή απάντηση που περιλαμβάνεται στο εξεταστικό έγγραφο. Λαμβάνει επίσης υπόψη το γεγονός ότι οι σημειώσεις των απαντήσεων των εξεταζόμενων μπορεί να είναι είτε πολύ γενικές, βελτιωμένες και όχι συγκεκριμένες, είτε πολύ σύντομες.
και ανεπαρκώς τεκμηριωμένη. Δίνεται μεγάλη προσοχή στην επισήμανση των στοιχείων της απάντησης, που υπολογίζονται σε ένα σημείο. Αυτό λαμβάνει υπόψη το αναπόφευκτο της σταδιακής αύξησης της δυσκολίας απόκτησης κάθε επόμενης βαθμολογίας.
για ένα καλά διατυπωμένο στοιχείο περιεχομένου.
Κατά τη σύνταξη της κλίμακας αξιολόγησης για εργασίες υπολογισμού (33 και 34), λαμβάνεται υπόψη η δυνατότητα διάφορων τρόπων επίλυσής τους και, κατά συνέπεια, η παρουσία στην απάντηση του εξεταζόμενου των κύριων σταδίων και των αποτελεσμάτων της ολοκλήρωσης των εργασιών που υποδεικνύονται
στα κριτήρια αξιολόγησης. Ας επεξηγήσουμε τη μεθοδολογία για την αξιολόγηση των εργασιών με μια λεπτομερή απάντηση συγκεκριμένα παραδείγματα.
2017-2018 ακαδημαϊκό έτος
ΚαθήκονταΜέγιστη βαθμολογία
Επίπεδο δουλειάς
Εργασία 30
2016-2017
Οι εργασίες 30 επικεντρώνονται στη δοκιμή της ικανότητας προσδιορισμού του βαθμού οξείδωσης χημικά στοιχεία, προσδιορίστε τον οξειδωτικό και αναγωγικό παράγοντα, προβλέψτε τα προϊόντα των αντιδράσεων οξειδοαναγωγής, καθορίστε τους τύπους των ουσιών που παραλείπονται στο σχήμα αντίδρασης, συντάξτε έναν ηλεκτρονικό ζυγό και χρησιμοποιήστε τον για να ορίσετε τους συντελεστές στις εξισώσεις αντίδρασης.
Η κλίμακα για την αξιολόγηση της απόδοσης τέτοιων εργασιών περιλαμβάνει τα ακόλουθα στοιχεία:
έχει συνταχθεί ηλεκτρονικό ισοζύγιο - 1 βαθμός.
υποδεικνύεται ο οξειδωτικός παράγοντας και ο αναγωγικός παράγοντας - 1 βαθμός.
προσδιορίζονται οι τύποι των ουσιών που λείπουν και τοποθετούνται οι συντελεστές
στην εξίσωση αντίδρασης οξειδοαναγωγής - 1 βαθμός.
Παράδειγμα εργασίας:
Χρησιμοποιώντας τη μέθοδο του ισοζυγίου ηλεκτρονίων, γράψτε την εξίσωση για την αντίδραση
Na 2 SO 3 + ... + KOH K 2 MnO 4 + ... + H 2 O
Προσδιορίστε τον οξειδωτικό και τον αναγωγικό παράγοντα.
Πόντοι
Πιθανή απάντηση
Mn +7 + ē → Mn +6
S +4 – 2ē → S +6
Το θείο σε κατάσταση οξείδωσης +4 (ή θειώδες νάτριο λόγω του θείου σε κατάσταση οξείδωσης +4) είναι ένας αναγωγικός παράγοντας.
Μαγγάνιο σε κατάσταση οξείδωσης +7 (ή υπερμαγγανικό κάλιο λόγω μαγγανίου
σε κατάσταση οξείδωσης +7) - ένας οξειδωτικός παράγοντας.
Na 2 SO 3 + 2KMnO 4 + 2KOH \u003d Na 2 SO 4 + 2K 2 MnO 4 + H 2 O
Η απάντηση είναι σωστή και πλήρης:
προσδιορίζεται ο βαθμός οξείδωσης των στοιχείων, τα οποία είναι, αντίστοιχα, ένας οξειδωτικός και ένας αναγωγικός παράγοντας στην αντίδραση.
καταγράφονται οι διαδικασίες οξείδωσης και αναγωγής και στη βάση τους συντάσσεται ηλεκτρονική (ηλεκτρονιονική) ισορροπία.
προσδιορίζονται οι ουσίες που λείπουν στην εξίσωση αντίδρασης, τοποθετούνται όλοι οι συντελεστές
Μέγιστη βαθμολογία
Κατά την αξιολόγηση της απάντησης του εξεταζόμενου, πρέπει να ληφθεί υπόψη ότι δεν υπάρχουν ενιαίες απαιτήσεις για το σχεδιασμό της απάντησης σε αυτή την εργασία. Ως αποτέλεσμα, η σύνταξη τόσο των ηλεκτρονικών όσο και των ηλεκτρονιονικών ζυγών γίνεται αποδεκτή ως η σωστή απάντηση και η ένδειξη του οξειδωτικού και του αναγωγικού παράγοντα μπορεί να γίνει με οποιονδήποτε αναμφισβήτητα κατανοητό τρόπο. Ωστόσο, εάν η απάντηση περιέχει στοιχεία της απάντησης που αλληλοαποκλείονται ως προς το νόημα, τότε δεν μπορούν να θεωρηθούν σωστά.
Εργασίες της μορφής 2018
1. Εργασία 30 (2 βαθμοί)
Για να ολοκληρώσετε την εργασία, χρησιμοποιήστε την ακόλουθη λίστα ουσιών: υπερμαγγανικό κάλιο, υδροχλώριο, χλωριούχο νάτριο, ανθρακικό νάτριο, χλωριούχο κάλιο. Η χρήση υδατικών διαλυμάτων ουσιών είναι αποδεκτή.
Από την προτεινόμενη λίστα ουσιών, επιλέξτε ουσίες μεταξύ των οποίων είναι δυνατή η αντίδραση οξειδοαναγωγής και σημειώστε την εξίσωση αυτής της αντίδρασης. Δημιουργήστε ηλεκτρονικό ισοζύγιο, υποδείξτε τον οξειδωτικό και τον αναγωγικό παράγοντα.
Εξήγηση.
Ας γράψουμε την εξίσωση αντίδρασης:
Ας κάνουμε ένα ηλεκτρονικό ισοζύγιο:

Το χλώριο σε κατάσταση οξείδωσης -1 είναι αναγωγικός παράγοντας. Το μαγγάνιο σε κατάσταση οξείδωσης +7 είναι ένας οξειδωτικός παράγοντας.ΣΥΝΟΛΟ 2 βαθμοί
επιλέγονται ουσίες, γράφεται η εξίσωση της αντίδρασης οξειδοαναγωγής, τοποθετούνται όλοι οι συντελεστές.
καταγράφονται οι διαδικασίες οξείδωσης και αναγωγής και στη βάση τους συντάσσεται ηλεκτρονική (ηλεκτρονιονική) ισορροπία. που είναι, αντίστοιχα, ένας οξειδωτικός και ένας αναγωγικός παράγοντας στην αντίδραση.
Έγινε σφάλμα μόνο σε ένα από τα παραπάνω στοιχεία απόκρισης
Έγιναν σφάλματα σε δύο από τα παραπάνω στοιχεία απόκρισης
Όλα τα στοιχεία της απάντησης είναι γραμμένα λάθος
Μέγιστη βαθμολογία
Εργασίες της μορφής 2018
1. Εργασία 31 (2 βαθμοί)
Για να ολοκληρώσετε την εργασία, χρησιμοποιήστε την ακόλουθη λίστα ουσιών: υπερμαγγανικό κάλιο, διττανθρακικό κάλιο, θειώδες νάτριο, θειικό βάριο, υδροξείδιο του καλίου. Η χρήση υδατικών διαλυμάτων ουσιών είναι αποδεκτή.
Εξήγηση.
Πιθανή απάντηση:
2. Εργασία 31
Για να ολοκληρώσετε την εργασία, χρησιμοποιήστε τον ακόλουθο κατάλογο ουσιών: υδροχλώριο, νιτρικός άργυρος (I), υπερμαγγανικό κάλιο, νερό, Νιτρικό οξύ. Η χρήση υδατικών διαλυμάτων ουσιών είναι αποδεκτή.
Από την προτεινόμενη λίστα ουσιών, επιλέξτε ουσίες μεταξύ των οποίων είναι δυνατή μια αντίδραση ανταλλαγής ιόντων. Γράψτε τις μοριακές, πλήρεις και συντομευμένες ιοντικές εξισώσεις για αυτήν την αντίδραση.
Εξήγηση.
Πιθανή απάντηση:
Εργασία 32. Εργασίες της μορφής 2018
Στην προϋπόθεση της εργασίας 32, όσοι δοκιμάζουν τη γνώση της γενετικής σχέσης διαφόρων τάξεων δεν το κάνουν οργανική ύλη, προτείνεται περιγραφή ενός συγκεκριμένου χημικού πειράματος, την πορεία του οποίου οι εξεταζόμενοι θα πρέπει να απεικονίσουν μέσω των εξισώσεων των αντίστοιχων χημικών αντιδράσεων. Η κλίμακα βαθμολόγησης εργασιών παραμένει, όπως και το 2016, ίση με 4 βαθμούς: κάθε σωστά γραμμένη εξίσωση αντίδρασης υπολογίζεται σε 1 βαθμό.
Παράδειγμα εργασίας:
Ο σίδηρος διαλύθηκε σε θερμό πυκνό θειικό οξύ. Το προκύπτον άλας κατεργάστηκε με περίσσεια διαλύματος υδροξειδίου του νατρίου. Το καφέ ίζημα που σχηματίστηκε διηθήθηκε και ξηράνθηκε. Η προκύπτουσα ουσία θερμάνθηκε με σίδηρο.
Γράψτε τις εξισώσεις για τις τέσσερις αντιδράσεις που περιγράφηκαν.
Περιεχόμενο σωστής απάντησης και οδηγίες βαθμολόγησης(Επιτρέπονται και άλλες διατυπώσεις της απάντησης που δεν αλλοιώνουν το νόημά της)Πόντοι
Πιθανή απάντηση
Γράφονται τέσσερις εξισώσεις των αντιδράσεων που περιγράφονται:
1) 2Fe + 6H 2 SO 4  Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
2) Fe 2 (SO 4 ) 3 + 6NaOH = 2Fe(OH) 3 + 3Na 2 SO 4
3) 2Fe(OH) 3  Fe 2 O 3 + 3H 2 O
Fe 2 O 3 + 3H 2 O
4) Fe 2 O 3 + Fe = 3FeO
Όλες οι εξισώσεις αντίδρασης είναι γραμμένες λανθασμένα
Μέγιστη βαθμολογία
Πρέπει να σημειωθεί ότι η απουσία συντελεστών (τουλάχιστον ενός) μπροστά από τους τύπους των ουσιών στις εξισώσεις αντίδρασης θεωρείται σφάλμα. Η βαθμολογία για μια τέτοια εξίσωση δεν ορίζεται.
Εργασία 33. Εργασίες της μορφής 2018
Οι εργασίες 33 ελέγχουν την αφομοίωση της γνώσης σχετικά με τη σχέση οργανικών ουσιών και προβλέπουν την επαλήθευση πέντε στοιχείων του περιεχομένου: την ορθότητα γραφής των πέντε εξισώσεων αντίδρασης που αντιστοιχούν στο σχήμα - την "αλυσίδα" μετασχηματισμών. Κατά τη σύνταξη των εξισώσεων αντίδρασης, οι εξεταζόμενοι πρέπει να χρησιμοποιούν τους συντακτικούς τύπους των οργανικών ουσιών. Η παρουσία κάθε στοιχείου ελεγμένου περιεχομένου στην απάντηση υπολογίζεται σε 1 βαθμό. Ο μέγιστος αριθμός πόντων για την ολοκλήρωση τέτοιων εργασιών είναι 5.
Παράδειγμα εργασίας:
Γράψτε τις εξισώσεις αντίδρασης που μπορούν να χρησιμοποιηθούν για να πραγματοποιηθούν οι ακόλουθοι μετασχηματισμοί:

Όταν γράφετε εξισώσεις αντίδρασης, χρησιμοποιήστε τους συντακτικούς τύπους των οργανικών ουσιών.
Περιεχόμενο σωστής απάντησης και οδηγίες βαθμολόγησηςεπιτρέπονται άλλες διατυπώσεις της απάντησης που δεν αλλοιώνουν το νόημά της)
Πόντοι
Πιθανή απάντηση
Γράφτηκαν πέντε εξισώσεις αντίδρασης που αντιστοιχούν στο σχήμα μετασχηματισμού:


Σωστά γραμμένες πέντε εξισώσεις αντίδρασης
Σωστά γραμμένες τέσσερις εξισώσεις αντίδρασης
Τρεις εξισώσεις αντίδρασης είναι γραμμένες σωστά
Σωστά γραμμένες δύο εξισώσεις αντίδρασης
Σωστά γραμμένη μια εξίσωση αντίδρασης
Όλα τα στοιχεία της απάντησης είναι γραμμένα λάθος
Μέγιστη βαθμολογία
Σημειώστε ότι στην απάντηση του εξεταζόμενου επιτρέπεται η χρήση δομικών τύπων διαφορετικό είδος(διευρυμένο, συντομευμένο, σκελετικό), που αντικατοπτρίζει ξεκάθαρα τη σειρά σύνδεσης των ατόμων και αμοιβαία διευθέτησηυποκαταστάτες και λειτουργικές ομάδες
σε ένα οργανικό μόριο.
Εργασία 34. Εργασίες της μορφής 2018
Οι εργασίες 34 είναι εργασίες υπολογισμού. Η εφαρμογή τους απαιτεί γνώση Χημικές ιδιότητεςουσίες και περιλαμβάνει την υλοποίηση ενός συγκεκριμένου συνόλου ενεργειών για να διασφαλιστεί ότι λαμβάνεται η σωστή απάντηση. Μεταξύ αυτών των ενεργειών είναι οι εξής:
– σύνταξη εξισώσεων χημικών αντιδράσεων (σύμφωνα με τις συνθήκες του προβλήματος) απαραίτητες για την εκτέλεση στοιχειομετρικών υπολογισμών.
– εκτέλεση υπολογισμών που είναι απαραίτητοι για την εύρεση απαντήσεων στο σύνολο
ερωτήσεις στην κατάσταση του προβλήματος?
- διατύπωση μιας λογικά αιτιολογημένης απάντησης σε όλα τα ερωτήματα που τίθενται στη συνθήκη εργασίας (για παράδειγμα, για τη δημιουργία ενός μοριακού τύπου).
Ωστόσο, θα πρέπει να ληφθεί υπόψη ότι δεν πρέπει να υπάρχουν όλες αυτές οι ενέργειες κατά την επίλυση οποιωνδήποτε πρόβλημα υπολογισμού, και σε ορισμένες περιπτώσεις ορισμένα από αυτά μπορούν να χρησιμοποιηθούν περισσότερες από μία φορές.
Η μέγιστη βαθμολογία για την ολοκλήρωση της εργασίας είναι 4 βαθμοί. Κατά τον έλεγχο, θα πρέπει πρώτα απ 'όλα να δώσετε προσοχή στη λογική εγκυρότητα των ενεργειών που εκτελούνται, καθώς ορισμένες εργασίες μπορούν να επιλυθούν με διάφορους τρόπους. Ταυτόχρονα, για να αξιολογηθεί αντικειμενικά η προτεινόμενη μέθοδος επίλυσης του προβλήματος, είναι απαραίτητο να ελεγχθεί η ορθότητα των ενδιάμεσων αποτελεσμάτων που χρησιμοποιήθηκαν για τη λήψη της απάντησης.
Παράδειγμα εργασίας:
Προσδιορίστε τα κλάσματα μάζας (σε%) θειικού σιδήρου (II) και θειούχου αργιλίου
σε ένα μείγμα, εάν κατά την επεξεργασία 25 g αυτού του μείγματος με νερό, απελευθερώθηκε αέριο, το οποίο αντέδρασε πλήρως με 960 g διαλύματος 5% θειικού χαλκού.
Στην απάντησή σας, γράψτε τις εξισώσεις αντίδρασης που υποδεικνύονται στην συνθήκη του προβλήματος,
και δώστε όλους τους απαραίτητους υπολογισμούς (αναφέρετε τις μονάδες μέτρησης των απαιτούμενων φυσικών μεγεθών).
Πιθανή απάντηση
Οι εξισώσεις αντίδρασης συντίθενται:
Η ποσότητα της ουσίας υδρόθειου υπολογίστηκε:
Η ποσότητα της ουσίας και η μάζα του θειούχου αργιλίου και του θειικού σιδήρου(II) υπολογίστηκαν:

Προσδιορίστηκαν τα κλάσματα μάζας θειικού σιδήρου(II) και θειούχου αργιλίου στο αρχικό μείγμα:
ω(FeSO 4 ) \u003d 10 / 25 \u003d 0,4 ή 40%
ω (Al 2 S 3) \u003d 15 / 25 \u003d 0,6 ή 6 0%
Η απάντηση είναι σωστή και πλήρης:
Στην απάντηση, οι εξισώσεις αντίδρασης που αντιστοιχούν στη συνθήκη εργασίας είναι σωστά γραμμένες.
έχουν γίνει σωστά οι υπολογισμοί που χρησιμοποιούν τις απαραίτητες φυσικές ποσότητες που καθορίζονται στη συνθήκη εργασίας.
απέδειξε μια λογικά αιτιολογημένη σχέση φυσικών μεγεθών, βάσει της οποίας πραγματοποιούνται οι υπολογισμοί·
σύμφωνα με την προϋπόθεση της ανάθεσης προσδιορίζεται η απαιτούμενη φυσική ποσότητα
Έγινε σφάλμα μόνο σε ένα από τα παραπάνω στοιχεία απόκρισης
Όλα τα στοιχεία της απάντησης είναι γραμμένα λάθος
Μέγιστη βαθμολογία
Κατά τον έλεγχο της απάντησης, ο εξεταζόμενος πρέπει να λάβει υπόψη το γεγονός ότι στην περίπτωση που η απάντηση περιέχει σφάλμα στους υπολογισμούς σε ένα από τα τρία στοιχεία (δεύτερο, τρίτο ή τέταρτο), το οποίο οδήγησε σε λανθασμένη απάντηση, ο βαθμός για η ολοκλήρωση της εργασίας μειώνεται μόνο κατά 1 βαθμό.
Εργασία 35. Εργασίες της μορφής 2018
Οι εργασίες 35 περιλαμβάνουν τον προσδιορισμό του μοριακού τύπου μιας ουσίας. Η εκπλήρωση αυτής της εργασίας περιλαμβάνει τις ακόλουθες διαδοχικές πράξεις: διεξαγωγή των υπολογισμών που είναι απαραίτητοι για τον καθορισμό του μοριακού τύπου μιας οργανικής ουσίας, γραφή του μοριακού τύπου μιας οργανικής ουσίας, σύνταξη ενός δομικού τύπου μιας ουσίας που αντικατοπτρίζει ξεκάθαρα τη σειρά σύνδεσης άτομα στο μόριό του, γράφοντας μια εξίσωση αντίδρασης που πληροί τη συνθήκη εργασίας.
Η κλίμακα βαθμολόγησης για την εργασία 35 στο μέρος 2 του γραπτού εξέτασης θα είναι 3 μονάδες.
Οι εργασίες 35 χρησιμοποιούν έναν συνδυασμό επαληθεύσιμων στοιχείων περιεχομένου - υπολογισμούς, βάσει των οποίων προσδιορίζουν τον μοριακό τύπο μιας ουσίας, συντάσσουν έναν γενικό τύπο μιας ουσίας και, στη συνέχεια, προσδιορίζουν, βάσει αυτού, τον μοριακό και δομικό τύπο μιας ουσίας.
Όλες αυτές οι ενέργειες μπορούν να εκτελεστούν με διαφορετική σειρά. Με άλλα λόγια, ο εξεταζόμενος μπορεί να καταλήξει στην απάντηση με όποιον λογικό τρόπο έχει στη διάθεσή του. Επομένως, κατά την αξιολόγηση μιας εργασίας, η κύρια προσοχή δίνεται στην ορθότητα της επιλεγμένης μεθόδου για τον προσδιορισμό του μοριακού τύπου μιας ουσίας.
Παράδειγμα εργασίας:
Κατά την καύση ενός δείγματος ορισμένων οργανική ένωσηβάρους 14,8 g έλαβε 35,2 g διοξείδιο του άνθρακακαι 18,0 g νερό.
Είναι γνωστό ότι η σχετική πυκνότητα ατμών υδρογόνου αυτής της ουσίας είναι 37. Κατά τη μελέτη των χημικών ιδιοτήτων αυτής της ουσίας, διαπιστώθηκε ότι η αλληλεπίδραση αυτής της ουσίας με το οξείδιο του χαλκού(II) σχηματίζει μια κετόνη.
Με βάση αυτούς τους όρους της ανάθεσης:
1) να κάνετε τους απαραίτητους υπολογισμούς για τον καθορισμό του μοριακού τύπου της οργανικής ύλης (αναφέρετε τις μονάδες μέτρησης των απαιτούμενων φυσικών μεγεθών).
γράψτε τον μοριακό τύπο της αρχικής οργανικής ύλης.
2) συνθέτω δομικός τύποςαυτή η ουσία, η οποία αντανακλά ξεκάθαρα τη σειρά δεσμών των ατόμων στο μόριό της.
3) γράψτε την εξίσωση για την αντίδραση αυτής της ουσίας με οξείδιο του χαλκού(II) χρησιμοποιώντας τον συντακτικό τύπο της ουσίας.
Περιεχόμενο σωστής απάντησης και οδηγίες βαθμολόγησης(Επιτρέπονται και άλλες διατυπώσεις της απάντησης που δεν αλλοιώνουν το νόημά της)
Πόντοι
Πιθανή απάντηση
Η ποσότητα της ουσίας των προϊόντων καύσης βρέθηκε:
Ο γενικός τύπος μιας ουσίας είναι C x H y O z
n (CO 2) \u003d 35,2 / 44 \u003d 0,8 mol; n (C) = 0,8 mol
n(H 2 O) \u003d 18,0 / 18 \u003d 1,0 mol; n(H) = 1,0 ∙ 2 = 2,0 mol
m (O) \u003d 14,8 - 0,8 ∙ 12 - 2 \u003d 3,2 g; n (O) \u003d 3,2 ⁄ 16 \u003d 0,2 mol
Ο μοριακός τύπος της ουσίας προσδιορίζεται:
x : y : z = 0,8: 2: 0,2 = 4: 10: 1
Ο απλούστερος τύπος είναι C 4 H 10 O
M απλό (C 4 H 10 O) = 74 g/mol
M ist (C x H y O z) \u003d 37 ∙ 2 \u003d 74 g / mol
Ο μοριακός τύπος της αρχικής ουσίας είναι C 4 H 10 O
Ο δομικός τύπος της ουσίας έχει συνταχθεί:

Η εξίσωση για την αντίδραση μιας ουσίας με το οξείδιο του χαλκού (II) γράφεται:
Η απάντηση είναι σωστή και πλήρης:
οι υπολογισμοί που είναι απαραίτητοι για τον καθορισμό του μοριακού τύπου μιας ουσίας έχουν γίνει σωστά· ο μοριακός τύπος της ουσίας καταγράφεται.
γράφεται ο δομικός τύπος της οργανικής ουσίας, ο οποίος αντικατοπτρίζει τη σειρά δεσμών και την αμοιβαία διάταξη των υποκαταστατών και των λειτουργικών ομάδων στο μόριο σύμφωνα με τη συνθήκη εκχώρησης·
γράφεται η εξίσωση της αντίδρασης, η οποία υποδεικνύεται στη συνθήκη εργασίας, χρησιμοποιώντας τον δομικό τύπο της οργανικής ύλης
Έγινε σφάλμα μόνο σε ένα από τα παραπάνω στοιχεία απόκρισης
Έγιναν σφάλματα σε δύο από τα παραπάνω στοιχεία απόκρισης
Έγιναν σφάλματα σε τρία από τα παραπάνω στοιχεία απόκρισης
Όλα τα στοιχεία της απάντησης είναι γραμμένα λάθος
Όλα τα στοιχεία της απάντησης είναι γραμμένα λάθος
Μέγιστη βαθμολογία
ΣΥΝΟΛΟ μέρος 2
2+2+ 4+5+4 +3=20 βαθμοί
Βιβλιογραφία
1. Μεθοδικά υλικάγια προέδρους και μέλη θεματικών επιτροπών θεμάτων Ρωσική Ομοσπονδίαγια να ελέγξετε την απόδοση των εργασιών με μια λεπτομερή απάντηση εξεταστικά χαρτιάΧΡΗΣΗ 2017. Αρθρο " Κατευθυντήριες γραμμέςγια την αξιολόγηση της απόδοσης των εργασιών USE με μια λεπτομερή ερώτηση. Μόσχα, 2017.
2. Έργο οργάνων FIPI ΧΡΗΣΗ υλικών 2018.
3. Εκδόσεις επίδειξης, προδιαγραφές, κωδικοποιητές USE 2018. Ιστότοπος FIPI.
4. Βεβαίωση προγραμματισμένων αλλαγών στο ΚΙΜ 2018. Ιστότοπος FIPI.
5. Ιστοσελίδα «Θα λύσω την εξέταση»: χημεία, στον ειδικό.
Για την επίλυση προβλημάτων αυτού του τύπου, είναι απαραίτητο να γνωρίζουμε τους γενικούς τύπους για τις κατηγορίες οργανικών ουσιών και τους γενικούς τύπους για τον υπολογισμό της μοριακής μάζας ουσιών αυτών των κατηγοριών:


Αλγόριθμος Αποφάσεων Πλειοψηφίας εργασίες για την εύρεση του μοριακού τύπουπεριλαμβάνει τα ακόλουθα βήματα:
— εγγραφή εξισώσεων αντίδρασης στο γενική εικόνα;
- εύρεση της ποσότητας της ουσίας n, για την οποία δίνεται η μάζα ή ο όγκος ή η μάζα ή ο όγκος της οποίας μπορεί να υπολογιστεί σύμφωνα με την κατάσταση του προβλήματος.
- εύρεση της μοριακής μάζας της ουσίας M = m / n, ο τύπος της οποίας πρέπει να καθοριστεί.
- εύρεση του αριθμού των ατόμων άνθρακα σε ένα μόριο και σύνταξη του μοριακού τύπου μιας ουσίας.
Παραδείγματα επίλυσης του προβλήματος 35 της Ενιαίας Πολιτικής Εξέτασης στη Χημεία για την εύρεση του μοριακού τύπου της οργανικής ύλης από προϊόντα καύσης με μια εξήγηση
Από την καύση 11,6 g οργανικής ύλης παράγονται 13,44 λίτρα διοξειδίου του άνθρακα και 10,8 g νερού. Η πυκνότητα ατμών αυτής της ουσίας στον αέρα είναι 2. Έχει διαπιστωθεί ότι αυτή η ουσία αλληλεπιδρά με διάλυμα αμμωνίαςοξείδιο του αργύρου, ανάγεται καταλυτικά με υδρογόνο για να σχηματίσει μια πρωτοταγή αλκοόλη και μπορεί να οξειδωθεί με ένα οξινισμένο διάλυμα υπερμαγγανικού καλίου σε καρβοξυλικό οξύ. Με βάση αυτά τα δεδομένα:
1) καθιερώστε τον απλούστερο τύπο της αρχικής ουσίας,
2) να κάνει τον δομικό τύπο του,
3) να δώσετε την εξίσωση της αντίδρασης για την αλληλεπίδρασή της με το υδρογόνο.
Απόφαση:ο γενικός τύπος της οργανικής ύλης είναι CxHyOz.
Ας μεταφράσουμε τον όγκο του διοξειδίου του άνθρακα και τη μάζα του νερού σε mol χρησιμοποιώντας τους τύπους:
n = Μ/Μκαι n = V/ VΜ,
Μοριακός όγκος Vm = 22,4 l/mol
n (CO 2) \u003d 13,44 / 22,4 \u003d 0,6 mol, => η αρχική ουσία περιείχε n (C) \u003d 0,6 mol,
n (H 2 O) \u003d 10,8 / 18 \u003d 0,6 mol, => η αρχική ουσία περιείχε διπλάσιο n (H) \u003d 1,2 mol,
Αυτό σημαίνει ότι η επιθυμητή ένωση περιέχει οξυγόνο στην ποσότητα:
n(O)= 3,2/16 = 0,2 mol
Ας δούμε την αναλογία των ατόμων C, H και O που αποτελούν την αρχική οργανική ύλη:
n(C) : n(H) : n(O) = x: y: z = 0,6: 1,2: 0,2 = 3: 6: 1
Βρήκαμε τον απλούστερο τύπο: C 3 H 6 O
Για να μάθουμε τον αληθινό τύπο, βρίσκουμε μοριακή μάζαοργανική ένωση σύμφωνα με τον τύπο:
M (CxHyOz) = Dair (CxHyOz) * M (αέρας)
M ist (CxHyOz) \u003d 29 * 2 \u003d 58 g / mol
Ας ελέγξουμε αν η πραγματική μοριακή μάζα αντιστοιχεί στη μοριακή μάζα του απλούστερου τύπου:
M (C 3 H 6 O) \u003d 12 * 3 + 6 + 16 \u003d 58 g / mol - αντιστοιχεί, \u003d\u003e ο αληθινός τύπος συμπίπτει με τον απλούστερο.
Μοριακός τύπος: C 3 H 6 O
Από τα δεδομένα του προβλήματος: "αυτή η ουσία αλληλεπιδρά με ένα διάλυμα αμμωνίας οξειδίου του αργύρου, ανάγεται καταλυτικά από το υδρογόνο για να σχηματίσει μια πρωτογενή αλκοόλη και μπορεί να οξειδωθεί από ένα οξινισμένο διάλυμα υπερμαγγανικού καλίου σε καρβοξυλικό οξύ" συμπεραίνουμε ότι είναι αλδεΰδη.

2) Στην αλληλεπίδραση 18,5 g κορεσμένου μονοβασικού καρβοξυλικού οξέος με περίσσεια διαλύματος διττανθρακικού νατρίου, απελευθερώθηκαν 5,6 l (n.o.) αερίου. Προσδιορίστε τον μοριακό τύπο του οξέος.
3) Κάποιο περιοριστικό καρβοξυλικό μονοβασικό οξύ με μάζα 6 g απαιτεί την ίδια μάζα αλκοόλης για πλήρη εστεροποίηση. Αυτό αποδίδει 10,2 g εστέρα. Ορίστε τον μοριακό τύπο του οξέος.
4) Προσδιορίστε τον μοριακό τύπο του ακετυλενικού υδρογονάνθρακα εάν η μοριακή μάζα του προϊόντος της αντίδρασής του με περίσσεια υδροβρωμίου είναι 4 φορές μεγαλύτερη από τη μοριακή μάζα του αρχικού υδρογονάνθρακα
5) Κατά την καύση οργανικής ύλης με μάζα 3,9 g σχηματίστηκε μονοξείδιο του άνθρακα (IV) με μάζα 13,2 g και νερό με μάζα 2,7 g. Να εξάγετε τον τύπο της ουσίας, γνωρίζοντας ότι η πυκνότητα ατμών υδρογόνου αυτής της ουσίας είναι 39.
6) Κατά την καύση οργανικής ύλης με μάζα 15 g σχηματίστηκε μονοξείδιο του άνθρακα (IV) όγκου 16,8 l και νερό μάζας 18 g. Να εξάγετε τον τύπο της ουσίας γνωρίζοντας ότι η πυκνότητα ατμών του αυτή η ουσία όσον αφορά το υδροφθόριο είναι 3.
7) Κατά την καύση 0,45 g αέριας οργανικής ύλης, απελευθερώθηκαν 0,448 l (n.o.) διοξειδίου του άνθρακα, 0,63 g νερού και 0,112 l (n.o.) αζώτου. Πυκνότητα πηγής αέρια ουσίαάζωτο 1,607. Βρείτε τον μοριακό τύπο αυτής της ουσίας.
8) Από την καύση οργανικής ύλης απαλλαγμένης από οξυγόνο παρήχθησαν 4,48 l (Ν.Ο.) διοξειδίου του άνθρακα, 3,6 g νερού και 3,65 g υδροχλωρίου. Προσδιορίστε τον μοριακό τύπο της καμένης ένωσης.
9) Κατά την καύση οργανικής ύλης βάρους 9,2 g, σχηματίστηκε μονοξείδιο του άνθρακα (IV) με όγκο 6,72 l (n.o.) και νερό με μάζα 7,2 g. Ορίστε τον μοριακό τύπο της ουσίας.
10) Κατά την καύση οργανικής ύλης βάρους 3 g σχηματίστηκε μονοξείδιο του άνθρακα (IV) με όγκο 2,24 l (n.o.) και νερό με μάζα 1,8 g. Είναι γνωστό ότι η ουσία αυτή αντιδρά με ψευδάργυρο.
Με βάση αυτούς τους όρους της ανάθεσης:
1) κάνει τους απαραίτητους υπολογισμούς για τον καθορισμό του μοριακού τύπου μιας οργανικής ουσίας.
2) Καταγράψτε τον μοριακό τύπο της αρχικής οργανικής ύλης.
3) να φτιάξετε έναν δομικό τύπο αυτής της ουσίας, ο οποίος αντικατοπτρίζει ξεκάθαρα τη σειρά σύνδεσης των ατόμων στο μόριό της.
4) γράψτε την εξίσωση για την αντίδραση αυτής της ουσίας με ψευδάργυρο.
Στο τελευταίο μας άρθρο, μιλήσαμε για τις βασικές εργασίες στις εξετάσεις στη χημεία το 2018. Τώρα, πρέπει να αναλύσουμε λεπτομερέστερα τα καθήκοντα των αυξημένων (σε ΧΡΗΣΗ κωδικοποιητήστη χημεία 2018 - υψηλό επίπεδοπολυπλοκότητα) επίπεδο πολυπλοκότητας, που παλαιότερα αναφερόταν ως μέρος Γ.
Σε εργασίες προχωρημένο επίπεδομόνο πέντε (5) εργασίες σχετίζονται με την πολυπλοκότητα - Αρ. 30,31,32,33,34 και 35. Ας εξετάσουμε τα θέματα των εργασιών, πώς να προετοιμαστούμε για αυτές και πώς να λύσουμε δύσκολες εργασίες στην Ενιαία Κρατική Εξέταση στο Χημεία 2018.
Ένα παράδειγμα της εργασίας 30 στις εξετάσεις στη χημεία 2018
Αποσκοπεί στον έλεγχο των γνώσεων του μαθητή για τις αντιδράσεις οξειδοαναγωγής (ORD). Η ανάθεση περιέχει πάντα μια εξίσωση χημική αντίδρασημε παραλείψεις ουσιών εκατέρωθεν της αντίδρασης (αριστερή πλευρά - αντιδραστήρια, δεξιά πλευρά - προϊόντα). Για αυτήν την εργασία μπορούν να απονεμηθούν το πολύ τρεις (3) βαθμοί. Το πρώτο σημείο δίνεται για σωστή γέμισηπαραλείψεις στην αντίδραση και η σωστή εξίσωση της αντίδρασης (διάταξη συντελεστών). Το δεύτερο σημείο μπορεί να επιτευχθεί γράφοντας σωστά το υπόλοιπο του OVR και τελευταία βαθμολογίαδίνεται για τον σωστό ορισμό του ποιος είναι ο οξειδωτικός παράγοντας στην αντίδραση και ποιος είναι ο αναγωγικός παράγοντας. Ας αναλύσουμε τη λύση της εργασίας Νο. 30 από ΧΡΗΣΗ επιδείξεωνστη χημεία 2018:
Χρησιμοποιώντας τη μέθοδο του ισοζυγίου ηλεκτρονίων, γράψτε την εξίσωση για την αντίδραση
Na 2 SO 3 + ... + KOH à K 2 MnO 4 + ... + H 2 O
Προσδιορίστε τον οξειδωτικό και τον αναγωγικό παράγοντα.
Το πρώτο πράγμα που πρέπει να κάνετε είναι να τοποθετήσετε τα φορτία στα άτομα που υποδεικνύονται στην εξίσωση, αποδεικνύεται:
Na + 2 S +4 O 3 -2 + ... + K + O -2 H + à K + 2 Mn +6 O 4 -2 + ... + H + 2 O -2
Συχνά μετά από αυτή τη δράση, βλέπουμε αμέσως το πρώτο ζεύγος στοιχείων που άλλαξαν την κατάσταση οξείδωσης (CO), δηλαδή, από διαφορετικές πλευρές της αντίδρασης, το ίδιο άτομο έχει διαφορετική κατάσταση οξείδωσης. Στη συγκεκριμένη εργασία, δεν το παρατηρούμε αυτό. Επομένως, είναι απαραίτητο να επωφεληθείτε από πρόσθετες γνώσεις, δηλαδή, στην αριστερή πλευρά της αντίδρασης, βλέπουμε υδροξείδιο του καλίου ( ΚΟΗ), η παρουσία του οποίου μας λέει ότι η αντίδραση προχωρά σε αλκαλικό περιβάλλον. Στη δεξιά πλευρά, βλέπουμε μαγγανικό κάλιο και γνωρίζουμε ότι σε μια αλκαλική αντίδραση, το μαγγανικό κάλιο λαμβάνεται από το υπερμαγγανικό κάλιο, επομένως, το κενό στην αριστερή πλευρά της αντίδρασης είναι υπερμαγγανικό κάλιο ( KMnO 4 ). Αποδεικνύεται ότι στα αριστερά είχαμε μαγγάνιο σε CO +7, και στα δεξιά σε CO +6, έτσι μπορούμε να γράψουμε το πρώτο μέρος του ισοζυγίου OVR:
Mn +7 +1 μι — à Mn +6
Τώρα, μπορούμε να μαντέψουμε τι άλλο πρέπει να συμβεί στην αντίδραση. Αν το μαγγάνιο δέχεται ηλεκτρόνια, τότε κάποιος έπρεπε να του τα δώσει (τηρούμε τον νόμο της διατήρησης της μάζας). Εξετάστε όλα τα στοιχεία στην αριστερή πλευρά της αντίδρασης: το υδρογόνο, το νάτριο και το κάλιο βρίσκονται ήδη σε CO +1, που είναι το μέγιστο για αυτά, το οξυγόνο δεν θα παραδώσει τα ηλεκτρόνια του στο μαγγάνιο, πράγμα που σημαίνει ότι το θείο παραμένει στο CO +4 . Συμπεραίνουμε ότι το θείο εγκαταλείπει ηλεκτρόνια και περνά στην κατάσταση του θείου με CO +6. Τώρα μπορούμε να γράψουμε το δεύτερο μέρος του ισολογισμού:
μικρό +4 -2 μι — à μικρό +6
Κοιτάζοντας την εξίσωση, βλέπουμε ότι στη δεξιά πλευρά, δεν υπάρχει θείο και νάτριο πουθενά, πράγμα που σημαίνει ότι πρέπει να βρίσκονται στο κενό, και το θειικό νάτριο είναι μια λογική ένωση για να το γεμίσει ( NaSO 4 ).
Τώρα γράφεται το υπόλοιπο OVR (παίρνουμε την πρώτη βαθμολογία) και η εξίσωση παίρνει τη μορφή:
Na 2 SO 3 + KMnO 4 + ΚΟΗà K 2 MnO 4 + NaSO 4 + H 2 O
| Mn +7 +1 μι — à Mn +6 | 1 | 2 |
| S +4 -2e -à S+6 | 2 | 1 |
Είναι σημαντικό να γράψετε αμέσως σε αυτό το μέρος ποιος είναι ο οξειδωτικός παράγοντας και ποιος ο αναγωγικός παράγοντας, καθώς οι μαθητές συχνά εστιάζουν στην εξίσωση της εξίσωσης και απλά ξεχνούν να κάνουν αυτό το μέρος της εργασίας, χάνοντας έτσι έναν βαθμό. Εξ ορισμού, ένας οξειδωτικός παράγοντας είναι το σωματίδιο που αποκτά ηλεκτρόνια (στην περίπτωσή μας, μαγγάνιο) και ένας αναγωγικός παράγοντας είναι το σωματίδιο που δίνει ηλεκτρόνια (στην περίπτωσή μας, θείο), οπότε παίρνουμε:
Μέσο οξείδωσης: Mn +7 (KMnO 4 )
Αναγωγικό μέσο: μικρό +4 (Να 2 ΕΤΣΙ 3 )
Πρέπει να θυμόμαστε εδώ ότι υποδεικνύουμε την κατάσταση των σωματιδίων στην οποία βρίσκονταν όταν άρχισαν να παρουσιάζουν τις ιδιότητες ενός οξειδωτικού ή αναγωγικού παράγοντα, και όχι τις καταστάσεις στις οποίες ήρθαν ως αποτέλεσμα της οξειδοαναγωγής.
Τώρα, για να λάβετε την τελευταία βαθμολογία, πρέπει να εξισώσετε σωστά την εξίσωση (τακτοποιήστε τους συντελεστές). Χρησιμοποιώντας την ισορροπία, βλέπουμε ότι για να πάει από το θείο +4 σε κατάσταση +6, δύο μαγγάνιο +7 πρέπει να γίνουν μαγγάνιο +6 και βάζουμε 2 μπροστά από το μαγγάνιο:
Na 2 SO 3 + 2KMnO 4 + ΚΟΗà 2K 2 MnO 4 + NaSO 4 + H 2 O
Τώρα βλέπουμε ότι έχουμε 4 κάλιο στα δεξιά και μόνο τρία στα αριστερά, οπότε πρέπει να βάλουμε 2 μπροστά από το υδροξείδιο του καλίου:
Na 2 SO 3 + 2KMnO 4 + 2KOHà 2K 2 MnO 4 + NaSO 4 + H 2 O
Ως αποτέλεσμα, η σωστή απάντηση στην εργασία με αριθμό 30 είναι η εξής:
Na 2 SO 3 + 2KMnO 4 + 2KOHà 2K 2 MnO 4 + NaSO 4 + H 2 O
| Mn +7 +1e -à Mn+6 | 1 | 2 |
| S +4 -2e -à S+6 | 2 | 1 |
Μέσο οξείδωσης: Mn +7 (KMnO 4)
Αναγωγικό μέσο: μικρό +4 (Να 2 ΕΤΣΙ 3 )
Η λύση της εργασίας 31 στις εξετάσεις στη χημεία
Αυτή είναι μια αλυσίδα ανόργανων μετασχηματισμών. Για την επιτυχή ολοκλήρωση αυτής της εργασίας, είναι απαραίτητο να έχουμε καλή κατανόηση των αντιδράσεων που χαρακτηρίζουν τις ανόργανες ενώσεις. Η εργασία αποτελείται από τέσσερις (4) αντιδράσεις, για καθεμία από τις οποίες, μπορείτε να πάρετε έναν (1) βαθμό, για συνολικά τέσσερις (4) βαθμούς, μπορείτε να πάρετε τέσσερις (4) πόντους για την εργασία. Είναι σημαντικό να θυμάστε τους κανόνες για την ολοκλήρωση της εργασίας: όλες οι εξισώσεις πρέπει να εξισωθούν, ακόμα κι αν ο μαθητής έγραψε σωστά την εξίσωση, αλλά δεν εξισώσει, δεν θα λάβει έναν βαθμό. δεν είναι απαραίτητο να λύσετε όλες τις αντιδράσεις, μπορείτε να κάνετε μία και να πάρετε έναν (1) βαθμό, δύο αντιδράσεις και να πάρετε δύο (2) βαθμούς κ.λπ., δεν είναι απαραίτητο να συμπληρώσετε τις εξισώσεις με αυστηρή σειρά, για παράδειγμα, ο μαθητής μπορεί να κάνει την αντίδραση 1 και 3, τότε αυτό πρέπει να κάνετε και ταυτόχρονα να πάρετε δύο (2) βαθμούς, το κύριο πράγμα είναι να υποδείξετε ότι πρόκειται για αντιδράσεις 1 και 3. Ας αναλύσουμε τη λύση της εργασίας Νο. 31 από την δοκιμαστική έκδοση της εξέτασης στη χημεία το 2018:
Ο σίδηρος διαλύθηκε σε θερμό πυκνό θειικό οξύ. Το προκύπτον άλας κατεργάστηκε με περίσσεια διαλύματος υδροξειδίου του νατρίου. Το καφέ ίζημα που σχηματίστηκε διηθήθηκε και ξηράνθηκε. Η προκύπτουσα ουσία θερμάνθηκε με σίδηρο.
Γράψτε τις εξισώσεις για τις τέσσερις αντιδράσεις που περιγράφηκαν.
Για τη διευκόλυνση της λύσης, σε ένα προσχέδιο, μπορείτε να συντάξετε το ακόλουθο σχήμα:
Για να ολοκληρώσετε την εργασία, φυσικά, πρέπει να γνωρίζετε όλες τις προτεινόμενες αντιδράσεις. Ωστόσο, υπάρχουν πάντα κρυμμένες ενδείξεις για την κατάσταση (συμπυκνωμένο θειικό οξύ, περίσσεια υδροξειδίου του νατρίου, καφέ ίζημα, πυρωμένο, θερμαινόμενο με σίδηρο). Για παράδειγμα, ένας μαθητής δεν θυμάται τι συμβαίνει με το σίδερο όταν αλληλεπιδρά με συμπ. θειικό οξύ, αλλά θυμάται ότι το καφέ ίζημα του σιδήρου, μετά από επεξεργασία με αλκάλια, είναι πιθανότατα υδροξείδιο του σιδήρου 3 ( Υ = Fe(Ω) 3 ). Τώρα έχουμε την ευκαιρία, αντικαθιστώντας το Y στο γραπτό σχήμα, να προσπαθήσουμε να φτιάξουμε τις εξισώσεις 2 και 3. Τα επόμενα βήματα είναι καθαρά χημικά, επομένως δεν θα τα ζωγραφίσουμε με τόση λεπτομέρεια. Ο μαθητής πρέπει να θυμάται ότι η θέρμανση του υδροξειδίου του σιδήρου 3 οδηγεί στο σχηματισμό οξειδίου του σιδήρου 3 ( Ζ = Fe 2 Ο 3 ) και το νερό και η θέρμανση του οξειδίου του σιδήρου 3 με καθαρό σίδηρο θα τα φέρει στη μέση κατάσταση - οξείδιο σιδήρου 2 ( FeO). Η ουσία Χ, η οποία είναι άλας που λαμβάνεται μετά από αντίδραση με θειικό οξύ, ενώ δίνει υδροξείδιο σιδήρου 3 μετά από επεξεργασία με αλκάλια, θα είναι θειικός σίδηρος 3 ( Χ = Fe 2 (ΕΤΣΙ 4 ) 3 ). Είναι σημαντικό να μην ξεχνάμε να εξισώνουμε τις εξισώσεις. Ως αποτέλεσμα, η σωστή απάντηση στην εργασία με αριθμό 31 είναι η εξής:
| 1) 2Fe + 6H 2 SO 4 (k) α Fe 2 (SO 4) 3+ 3SO 2 + 6H 2 O |
| 2) Fe 2 (SO 4) 3+ 6NaOH (πρώην) à 2 Fe(OH) 3 + 3Na2SO4 |
| 3) 2Fe(OH)3à Fe 2 Ο 3 + 3Η2Ο |
| 4) Fe 2 Ο 3 + Fea 3FeO |
Εργασία 32 Ενιαία Κρατική Εξέταση στη Χημεία
Πολύ παρόμοια με την εργασία #31, μόνο που δίνει μια αλυσίδα οργανικών μετασχηματισμών. Οι απαιτήσεις σχεδίασης και η λογική λύσης είναι παρόμοιες με την εργασία #31, η μόνη διαφορά είναι ότι στην εργασία #32 δίνονται πέντε (5) εξισώσεις, που σημαίνει ότι μπορείτε να συγκεντρώσετε πέντε (5) βαθμούς συνολικά. Λόγω της ομοιότητας με τον αριθμό εργασίας 31, δεν θα το εξετάσουμε λεπτομερώς.
Η λύση της εργασίας 33 στη χημεία 2018
Η εργασία υπολογισμού, για την υλοποίησή της είναι απαραίτητο να γνωρίζετε τους βασικούς τύπους υπολογισμού, να είστε σε θέση να χρησιμοποιήσετε μια αριθμομηχανή και να σχεδιάσετε λογικούς παραλληλισμούς. Η εργασία #33 αξίζει τέσσερις (4) βαθμούς. Εξετάστε μέρος της λύσης στην εργασία Νο. 33 από την δοκιμαστική έκδοση USE στη χημεία 2018:
Προσδιορίστε τα κλάσματα μάζας (σε%) θειικού σιδήρου (II) και θειούχου αργιλίου στο μείγμα, εάν κατά την επεξεργασία 25 g αυτού του μείγματος με νερό, απελευθερώθηκε αέριο που αντέδρασε πλήρως με 960 g διαλύματος 5%. θειικός χαλκός Στην απάντηση, γράψτε τις εξισώσεις αντίδρασης που καθορίζονται στην κατάσταση του προβλήματος και δώστε όλους τους απαραίτητους υπολογισμούς (αναφέρετε τις μονάδες των απαιτούμενων φυσικών μεγεθών).
Παίρνουμε τον πρώτο (1) βαθμό για να γράψουμε τις αντιδράσεις που εμφανίζονται στο πρόβλημα. Η απόκτηση της συγκεκριμένης βαθμολογίας εξαρτάται από τις γνώσεις της χημείας, οι υπόλοιποι τρεις (3) βαθμοί μπορούν να ληφθούν μόνο μέσω υπολογισμών, επομένως, εάν ένας μαθητής έχει προβλήματα με τα μαθηματικά, πρέπει να λάβει τουλάχιστον έναν (1) βαθμό για την ολοκλήρωση της εργασίας Αρ. 33:
| Al 2 S 3 + 6H 2 Oà 2Al(OH)3 + 3H2S |
| CuSO 4 + H 2 Sà CuS + H 2 SO 4 |
Δεδομένου ότι οι περαιτέρω ενέργειες είναι καθαρά μαθηματικές, δεν θα τις αναλύσουμε εδώ. Μπορείτε να παρακολουθήσετε την ανάλυση επιλογής στο κανάλι μας στο YouTube (σύνδεσμος στην ανάλυση βίντεο της εργασίας Νο. 33).
Οι τύποι που θα απαιτηθούν για την επίλυση αυτής της εργασίας:
Εργασία 34 στη χημεία 2018
Εκτιμώμενη εργασία, η οποία διαφέρει από την εργασία Νο. 33 ως εξής:
- Εάν στην εργασία Νο. 33 γνωρίζουμε ποιες ουσίες αλληλεπιδρούν μεταξύ τους, τότε στην εργασία Νο. 34 πρέπει να βρούμε τι αντέδρασε.
- Στην εργασία Νο. 34, δίνονται οργανικές ενώσεις, ενώ στην εργασία Νο. 33, οι ανόργανες διεργασίες δίνονται συχνότερα.
Στην πραγματικότητα, η εργασία Νο. 34 είναι το αντίθετο της εργασίας Νο. 33, που σημαίνει ότι η λογική της εργασίας είναι αντίθετη. Για την εργασία Νο. 34, μπορείτε να πάρετε τέσσερις (4) βαθμούς, ενώ, όπως και στην εργασία Νο. 33, μόνο ένας από αυτούς (στο 90% των περιπτώσεων) λαμβάνεται για γνώση χημείας, οι υπόλοιποι 3 (λιγότερο συχνά 2) οι βαθμοί λαμβάνονται για μαθηματικούς υπολογισμούς . Για να ολοκληρώσετε με επιτυχία την εργασία Νο. 34, πρέπει:
Να γνωρίζουν τους γενικούς τύπους όλων των κύριων κατηγοριών οργανικών ενώσεων.
Να γνωρίζει τις βασικές αντιδράσεις των οργανικών ενώσεων.
Να είναι σε θέση να γράψει μια εξίσωση σε γενική μορφή.
Για άλλη μια φορά, θα ήθελα να σημειώσω ότι τα απαραίτητα για την επιτυχία περνώντας τις εξετάσειςστη χημεία το 2018, οι θεωρητικές βάσεις παρέμειναν πρακτικά αμετάβλητες, πράγμα που σημαίνει ότι όλες οι γνώσεις που έλαβε το παιδί σας στο σχολείο θα το βοηθήσουν να περάσει τις εξετάσεις στη χημεία το 2018. Στο κέντρο μας για την προετοιμασία για την Ενιαία Κρατική Εξέταση και τον Οδογράφο OGE, το παιδί σας θα λάβει όλααπαραίτητο για την προετοιμασία του θεωρητικού υλικού και στην τάξη θα εδραιώσει τις γνώσεις που αποκτήθηκαν για την επιτυχή εφαρμογή όλαεργασίες εξετάσεων. Οι καλύτεροι δάσκαλοι που έχουν περάσει από έναν πολύ μεγάλο διαγωνισμό και δύσκολο εισαγωγικές εξετάσεις. Τα μαθήματα γίνονται σε μικρές ομάδες, γεγονός που επιτρέπει στον δάσκαλο να αφιερώνει χρόνο σε κάθε παιδί και να διαμορφώνει την ατομική του στρατηγική για την ολοκλήρωση της εξεταστικής εργασίας.
Δεν έχουμε προβλήματα με την έλλειψη τεστ νέας μορφής, οι δάσκαλοί μας τα γράφουν μόνοι τους, με βάση όλες τις συστάσεις του κωδικοποιητή, του προσδιοριστή και της δοκιμαστικής έκδοσης της Ενιαίας Κρατικής Εξέτασης στη Χημεία 2018.
Καλέστε σήμερα και αύριο το παιδί σας θα σας ευχαριστήσει!
Εργασίες 35 από πραγματικά KIM της Ενιαίας Κρατικής Εξέτασης 2018 στη χημεία
1 επιλογή
Κατά την καύση 5,3 g οργανικής ένωσης, σχηματίστηκαν 8,96 l CO 2 και 4,5 g H 2 O. Όταν η ουσία αυτή οξειδώθηκε με διάλυμα υπερμαγγανικού καλίου σε θειικό οξύ, σχηματίστηκε ένα διβασικό οξύ, στο οποίο Οι καρβοξυλομάδες βρίσκονται σε γειτονικές θέσεις και δεν σχηματίζεται CO 2. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Ο γενικός τύπος της ουσίας είναι CxHy.
Ας γράψουμε την εξίσωση αντίδρασης:
CxHy + (x + y / 4) O2 \u003d xCO 2 + (y / 2) H 2 O
Ας προσδιορίσουμε την ποσότητα της ουσίας άνθρακα και υδρογόνου:
n(C) \u003d n (CO 2) \u003d 8,96 / 22,4 \u003d 0,4 mol
n(H) \u003d n (H 2 O) * 2 \u003d (4,5 / 18) * 2 \u003d 0,5 mol
Έτσι, η αναλογία των ποσοτήτων άνθρακα και υδρογόνου στην αρχική οργανική ύλη είναι περίπου 4:5.
Οι επιλογές περιλαμβάνουν C 4 H 5 , C 8 H 10 , C 12 H 15 , C 16 H 20 .
Με βάση γενικούς τύπουςδιάφορες κατηγορίες οργανικών ενώσεων, διαπιστώνουμε ότι η επιθυμητή ουσία C 8 H 10 (C n H 2 n -6) είναι 1,2-διμεθυλβενζόλιο, αφού μόνο αυτό στην αντίδραση με υπερμαγγανικό κάλιο σε όξινο μέσο σχηματίζει ένα διβασικό καρβοξυλικό οξύ. , στις οποίες οι καρβοξυλομάδες βρίσκονται σε γειτονικές θέσεις
Επιλογή 2
Κατά την καύση 21,6 g μιας οργανικής ένωσης, σχηματίστηκαν 31,36 l CO 2 και 14,4 g H 2 O. Η ουσία εισέρχεται σε μια αντίδραση εστεροποίησης με οξικό οξύ. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Σε μια αντίδραση εστεροποίησης με καρβοξυλικά οξέαμπαίνουν οι αλκοόλες.
Ο γενικός τύπος της ουσίας CxHyOz
Βρείτε την αναλογία άνθρακα και υδρογόνου:
n(C) \u003d n (CO 2) \u003d 31,36 / 22,4 \u003d 1,4 mol
n(H) \u003d n (H 2 O) * 2 \u003d (14,4 / 18) * 2 \u003d 1,6 mol
Η αναλογία άνθρακα προς υδρογόνο είναι 7 προς 8.
Αυτό είναι δυνατό στην ένωση C 7 H 8 O. Ας το ελέγξουμε με τη μάζα που δίνεται στην κατάσταση του προβλήματος.
n (C 7 H 8 O) \u003d 1,4 / 7 \u003d 0,2 mol.
M (C 7 H 8 O) \u003d 21,6 / 0,2 \u003d 108
M (C 7 H 8 O) \u003d 7 * 12 + 8 * 1 + 16 \u003d 108.
Λαμβάνοντας υπόψη ότι οι φαινόλες δεν εισέρχονται σε αντιδράσεις εστεροποίησης με καρβοξυλικά οξέα, η σωστή απάντηση είναι: βενζυλική αλκοόλη

3 επιλογή
Όταν καίγεται οργανική ύλη χωρίς οξυγόνο, σχηματίζονται 26,4 g CO 2 , 5,4 g H 2 O και 13,44 l HCl. Αυτή η ουσία μπορεί να ληφθεί με αντίδραση του αντίστοιχου υδρογονάνθρακα με περίσσεια HCl. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
n(C) \u003d n (CO 2) \u003d 26,4 / 44 \u003d 0,6 mol
n(H) \u003d n (H 2 O) * 2 + n (HCl) \u003d (5,4 / 18) * 2 + 13,44 / 22,4 \u003d 1,2 mol
n(Cl) \u003d n (HCl) \u003d 13,44 / 22,4 \u003d 0,6 mol
Η αναλογία άνθρακα προς υδρογόνο και χλώριο είναι 1:2:1.
Υπάρχει μόνο μία πιθανή επιλογή (με βάση τους υπάρχοντες γενικούς τύπους των παραπάνω κατηγοριών οργανικών ουσιών χωρίς οξυγόνο): C 2 H 4 Cl 2 - διχλωροαιθάνιο

4 επιλογή
Κατά την καύση 9 γραμμαρίων ουσίας που δεν περιέχει οξυγόνο, σχηματίζονται 12,6 g νερού και 2,24 λίτρα αζώτου και διοξειδίου του άνθρακα. Αυτή η ουσία μπορεί να ληφθεί με αναγωγή της νίτρο ένωσης με υδρογόνο παρουσία καταλύτη. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
n(N) \u003d 2 * n (N) \u003d 2 * 2,24 / 22,4 \u003d 0,2 mol
n (H) \u003d n (H 2 O) * 2 \u003d (12,6 / 18) * 2 \u003d 1,4 mol
Θεωρώντας. ότι το μόριο της επιθυμητής οργανικής ουσίας περιέχει 1 άτομο αζώτου, τότε η ποσότητα της ουσίας της επιθυμητής ένωσης είναι ίση με την ποσότητα της ουσίας αζώτου και ίση με 0,2 mol
Ας βρούμε τη μοριακή μάζα της επιθυμητής ένωσης: M \u003d m / n \u003d 9 / 0,2 \u003d 45
Η σύνθεση της ουσίας περιλαμβάνει 1 άτομο αζώτου, 7 άτομα υδρογόνου. Αφαιρέστε από το 45 τη σχετική ατομική μάζα 1 ατόμου αζώτου και 7 ατόμων υδρογόνου: 45 - 14 - 7 \u003d 24. Η ατομική μάζα του άνθρακα είναι 12. Δηλαδή, υπάρχουν 2 άτομα άνθρακα στο μόριο της επιθυμητής ουσίας
Απάντηση C 2 H 7 N - νιτροαιθάνιο

5 επιλογή
Από την καύση οργανικής ύλης που δεν περιέχει οξυγόνο παράγονται 19,8 g διοξειδίου του άνθρακα, 5,4 g νερού και 6,72 λίτρα HCl. Αυτή η ουσία μπορεί να ληφθεί με αντίδραση του αντίστοιχου υδρογονάνθρακα με περίσσεια HCl. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Ο γενικός τύπος της ουσίας CxHyClz
Βρείτε την αναλογία άνθρακα, υδρογόνου και χλωρίου:
n(C) \u003d n (CO 2) \u003d 19,8 / 44 \u003d 0,45 mol
n(H) \u003d n (H 2 O) * 2 + n (HCl) \u003d (5,4 / 18) * 2 + 6,72 / 22,4 \u003d 0,9 mol
n(Cl) \u003d n (HCl) \u003d 6,72 / 22,4 \u003d 0,3 mol
Η αναλογία άνθρακα προς υδρογόνο και χλώριο είναι 3:6:2.
Λαμβάνοντας υπόψη τη μέθοδο λήψης μιας ουσίας: την αλληλεπίδραση ενός υδρογονάνθρακα χωρίς οξυγόνο με περίσσεια HCl, συμπεραίνουμε ότι η ένωση ανήκει σε αλκένια, αλκίνια, αρένια ή αλκαδιένια.
Υπάρχει μόνο μία πιθανή επιλογή (με βάση τους υπάρχοντες γενικούς τύπους των παραπάνω κατηγοριών οργανικών ουσιών χωρίς οξυγόνο): C 3 H 6 Cl 2 - 2,2-διχλωροπροπάνιο
Είναι δυνατή η λήψη αυτής της ουσίας με υδροαλογόνωση από προπίνη

6 επιλογή
Κατά την καύση 1,86 γραμμαρίων ουσίας που δεν περιέχει οξυγόνο, σχηματίζονται 1,26 g νερού και 224 ml αζώτου. Αυτή η ουσία μπορεί να ληφθεί από την αντίστοιχη νίτρο ένωση. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Ο γενικός τύπος της ουσίας (λαμβάνοντας υπόψη τη μέθοδο λήψης σύμφωνα με την κατάσταση του προβλήματος): CxHyN
Η ποσότητα αζώτου και ουσίας υδρογόνου στην ένωση:
n(N) \u003d 2 * n (N) \u003d 2 * 0,224 / 22,4 \u003d 0,02 mol
n (H) \u003d n (H 2 O) * 2 \u003d (1,26 / 18) * 2 \u003d 0,14 mol
Η αναλογία αζώτου προς υδρογόνο είναι 1:7
Θεωρώντας. ότι το μόριο της επιθυμητής οργανικής ουσίας περιέχει 1 άτομο αζώτου, τότε η ποσότητα της ουσίας της επιθυμητής ένωσης είναι ίση με την ποσότητα της ουσίας αζώτου και είναι ίση με 0,02 mol
Ας βρούμε τη μοριακή μάζα της επιθυμητής ένωσης: M \u003d m / n \u003d 1,86 / 0,02 \u003d 93
Η σύνθεση της ουσίας περιλαμβάνει 1 άτομο αζώτου, 7 άτομα υδρογόνου. Αφαιρέστε από το 93 τη σχετική ατομική μάζα 1 ατόμου αζώτου και 7 ατόμων υδρογόνου: 93 - 14 - 7 \u003d 72. Η ατομική μάζα του άνθρακα είναι 12. Δηλαδή, υπάρχουν 6 άτομα άνθρακα στο μόριο της επιθυμητής ουσίας
Απάντηση C 6 H 7 N - νιτροβενζόλιο

7 επιλογή
Από την καύση οργανικής ύλης που δεν περιέχει οξυγόνο παράγονται 5,28 g διοξειδίου του άνθρακα, 0,72 g νερού και 4,48 λίτρα HCl. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Ο γενικός τύπος της ουσίας CxHyClz
Βρείτε την αναλογία άνθρακα, υδρογόνου και χλωρίου:
n(C) \u003d n (CO 2) \u003d 5,28 / 44 \u003d 0,12 mol
n (H) \u003d n (H 2 O) * 2 + n (HCl) \u003d (0,72 / 18) * 2 + 0,448 / 22,4 \u003d 0,1 mol
n(Cl) \u003d n (HCl) \u003d 0,448 / 22,4 \u003d 0,02 mol
Η αναλογία άνθρακα προς υδρογόνο και χλώριο είναι 6:5:1.
Λαμβάνοντας υπόψη τη μέθοδο λήψης μιας ουσίας: την αλληλεπίδραση ενός υδρογονάνθρακα χωρίς οξυγόνο με περίσσεια HCl, συμπεραίνουμε ότι η ένωση ανήκει σε αλκένια, αλκίνια, αρένια ή αλκαδιένια.
Υπάρχει μόνο μία πιθανή επιλογή (με βάση τους υπάρχοντες γενικούς τύπους των παραπάνω κατηγοριών οργανικών ουσιών χωρίς οξυγόνο): C 6 H 5 Cl - χλωροβενζόλιο

8 επιλογή
Όταν καίγονται 1,18 g δευτεροταγούς αμίνης, σχηματίζονται 1,344 λίτρα διοξειδίου του άνθρακα, 1,62 g νερού και άζωτο. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Γενικός τύπος της ουσίας: CxHyN
Η ποσότητα της ουσίας υδρογόνου και άνθρακα στην ένωση:
n (H) \u003d 2 * n (H 2 O) \u003d 2 * 1,62 / 18 \u003d 0,18 mol
n(C) \u003d n (CO 2) \u003d (1,344 / 22,4) \u003d 0,06 mol
Η αναλογία άνθρακα προς υδρογόνο είναι 1:3.
Η εξίσωση για την αντίδραση καύσης μιας δευτεροταγούς αμίνης έχει ως εξής:
2C x H 3 x N + 3,5xO 2 = 2xCO 2 + 3xH 2 O + N 2
Η μοριακή μάζα της επιθυμητής ένωσης είναι 12x+3x+14.
Η ποσότητα της ουσίας της επιθυμητής ένωσης είναι 0,06 / x
Χρησιμοποιώντας τον τύπο n=m/M παίρνουμε: 1,18/(12x+3x+14) = 0,06/x
1,18x = 0,9x + 0,84
Απάντηση C 3 H 9 N ή CH 3 - CH 2 - NH - CH 3 μεθυλαιθυλαμίνη

9 επιλογή
Κάποια ουσία περιέχει κατά μάζα 12,79% άζωτο, 43,84% άνθρακα και 32,42% χλώριο και σχηματίζεται από την αλληλεπίδραση μιας πρωτοταγούς αμίνης με το χλωροαιθάνιο. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Το κλάσμα μάζας του υδρογόνου είναι 100% - 12,79% - 43,84% - 32,42% = 10,95%
n(N) = 12,79/14 = 0,91
n(C) = 43,84/12 = 3,65
n(Cl) = 32,42 / 36,5 = 0,9
Όταν η πρωτοταγής αμίνη αλληλεπιδρά με το χλωροαιθάνιο, λαμβάνετε [(CH 3 -CH 2) 2 -NH 2] + Cl -

10 επιλογή
Το άλας οργανικού οξέος περιέχει 5,05% υδρογόνο, 42,42% άνθρακα, 32,32% οξυγόνο και 20,21% ασβέστιο. Όταν αυτό το άλας θερμαίνεται, σχηματίζεται μια καρβονυλική ένωση. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Ας πάρουμε τη μάζα της ένωσης ως 100 γραμμάρια, τότε η ποσότητα της ουσίας των στοιχείων είναι η εξής:
n(C) = 42,42/12 = 3,535
η(Η) = 5,05/1 = 5,05
n(O) = 32,32/16 = 2,02
n(Ca) = 20,21/40 = 0,505
7:10:4:1 (S:N:O:Ca)
Μοριακός τύπος της ουσίας C 7 H 10 O 4 Ca
Λαμβάνοντας υπόψη την αναλογία άνθρακα και υδρογόνου που χαρακτηρίζει ένα ακόρεστο μονοβασικό οξύ ή ένα κορεσμένο διβασικό οξύ, καθώς και την αντίδραση σχηματισμού μιας καρβονυλικής ένωσης κατά τη θέρμανση, μπορούμε να συμπεράνουμε ότι μιλάμε για το άλας ασβεστίου του πεντανίου-1 ,2-δικαρβοξυλικό οξύ

11 επιλογή
Η οργανική ύλη περιέχει 12,79% άζωτο, 10,95% υδρογόνο και 32,42% χλώριο. Η ουσία μπορεί να ληφθεί με αντίδραση μιας δευτεροταγούς αμίνης με χλωροαιθάνιο. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Το κλάσμα μάζας του άνθρακα είναι 100% - 12,79% - 10,95% - 32,42% = 43,84%
Ας βρούμε την αναλογία της ποσότητας της ουσίας άνθρακα, υδρογόνου, αζώτου και χλωρίου.
Ας πάρουμε τη μάζα της ένωσης ως 100 γραμμάρια, τότε η ποσότητα της ουσίας των στοιχείων είναι η εξής:
n(N) = 12,79/14 = 0,91
n(C) = 43,84/12 = 3,65
n(Cl) = 32,42 / 36,5 = 0,9
Η αναλογία αζώτου προς άνθρακα προς χλώριο και υδρογόνο είναι 1:4:1:12.
Όταν μια δευτεροταγής αμίνη αντιδρά με το χλωροαιθάνιο, λαμβάνεται χλωριούχο διμεθυλαιθυλαμίνη
[CH 3 -N (CH 3) -C 2 H 5] + Cl -

12 επιλογή
Το άλας οργανικού οξέος περιέχει 4,35% υδρογόνο, 39,13% άνθρακα, 34,78% οξυγόνο και 21,74% ασβέστιο. Όταν αυτό το άλας θερμαίνεται, σχηματίζεται μια καρβονυλική ένωση. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Ο γενικός τύπος της ουσίας: CxHyOzСa
Ας πάρουμε τη μάζα της ένωσης ως 100 γραμμάρια, τότε η ποσότητα της ουσίας των στοιχείων είναι η εξής:
n(C) = 39,13/12 = 3,26
η(Η) = 4,35/1 = 4,35
n(O) = 34,78/16 = 2,17
n(Ca) = 21,74/40 = 0,54
Η αναλογία των στοιχείων στο επιθυμητό αλάτι έχει ως εξής:
6:8:4:1 (S:N:O:Ca)
Μοριακός τύπος της ουσίας C 6 H 8 O 4 Ca
Λαμβάνοντας υπόψη την αναλογία άνθρακα και υδρογόνου, χαρακτηριστική ενός ακόρεστου μονοβασικού οξέος ή ενός κορεσμένου διβασικού οξέος, καθώς και την αντίδραση σχηματισμού μιας καρβονυλικής ένωσης κατά τη θέρμανση, μπορούμε να συμπεράνουμε ότι μιλάμε για το άλας ασβεστίου του βουτανίου- 1,2-δικαρβοξυλικό οξύ

13 επιλογή
Η οργανική ύλη περιέχει 9,09% άζωτο, 31,19% άνθρακα και 51,87% βρώμιο. Η ουσία μπορεί να ληφθεί με αντίδραση μιας πρωτοταγούς αμίνης με βρωμοαιθάνιο. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Το κλάσμα μάζας του υδρογόνου είναι 100% - 9,09% - 31,19% - 51,87% = 7,85%
Ας πάρουμε τη μάζα της ένωσης ως 100 γραμμάρια, τότε η ποσότητα της ουσίας των στοιχείων είναι η εξής:
n(N) = 9,09/14 = 0,65
n(C) = 31,19/12 = 2,6
n(Br) = 51,87/80 = 0,65
Η αναλογία αζώτου προς άνθρακα προς βρώμιο και υδρογόνο είναι 1:4:1:12.
Όταν μια πρωτοταγής αμίνη αντιδρά με βρωμοαιθάνιο, λαμβάνεται βρωμιούχο διαιθυλαμίνη
[(CH 3 -CH 2) 2 -NH 2] + Br -

14 επιλογή
Το άλας οργανικού οξέος περιέχει 28,48% άνθρακα, 3,39% υδρογόνο, 21,69% οξυγόνο και 46,44% βάριο. Όταν αυτό το άλας θερμαίνεται, σχηματίζεται μια καρβονυλική ένωση. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Ας πάρουμε τη μάζα της ένωσης ως 100 γραμμάρια, τότε η ποσότητα της ουσίας των στοιχείων είναι η εξής:
n(C) = 28,48/12 = 2,37
η(Η) = 3,39/1 = 3,39
n(O) = 21,69/16 = 1,36
n(Ba) = 46,44/137 = 0,34
Η αναλογία των στοιχείων στο επιθυμητό αλάτι έχει ως εξής:
7:10:4:1 (S:N:O:Wa)
Μοριακός τύπος της ουσίας C 7 H 10 O 4 Va
Λαμβάνοντας υπόψη την αναλογία άνθρακα και υδρογόνου που χαρακτηρίζει ένα ακόρεστο μονοβασικό οξύ ή ένα κορεσμένο διβασικό οξύ, καθώς και την αντίδραση σχηματισμού μιας καρβονυλικής ένωσης κατά τη θέρμανση, μπορούμε να συμπεράνουμε ότι μιλάμε για το άλας βαρίου του πεντανίου-1 ,2-δικαρβοξυλικό οξύ

15 επιλογή
Η οργανική ύλη περιέχει 10% άζωτο, 25,73% άνθρακα και 57,07% βρώμιο. Η ουσία μπορεί να ληφθεί με αντίδραση μιας πρωτοταγούς αμίνης με βρώμιο. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Το κλάσμα μάζας του υδρογόνου είναι 100% - 10% - 25,73% - 57,07% = 7,2%
Να βρείτε την αναλογία της ποσότητας της ουσίας άνθρακα, υδρογόνου, αζώτου και βρωμίου.
Ας πάρουμε τη μάζα της ένωσης ως 100 γραμμάρια, τότε η ποσότητα της ουσίας των στοιχείων είναι η εξής:
n(N) = 10/14 = 0,7
n(C) = 25,73/12 = 2,1
n(Br) = 57,07/80 = 0,7
Η αναλογία αζώτου προς άνθρακα προς βρώμιο και υδρογόνο είναι 1:3:1:10.
Κατά την αντίδραση μιας πρωτοταγούς αμίνης με βρώμιο, λαμβάνεται βρωμιούχο μεθυλαιθυλαμίνη
[(CH 3 -CH 2 -NH 2 -CH 3] + Br -

16 επιλογή
Το άλας οργανικού οξέος περιέχει 25,62% άνθρακα, 2,85% υδρογόνο, 22,78% οξυγόνο και 48,75% βάριο. Όταν αυτό το άλας θερμαίνεται, σχηματίζεται μια καρβονυλική ένωση. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Ο γενικός τύπος της ουσίας: CxHyOzBa
Ας πάρουμε τη μάζα της ένωσης ως 100 γραμμάρια, τότε η ποσότητα της ουσίας των στοιχείων είναι η εξής:
n(C) = 25,62/12 = 2,135
η(Η) = 2,85/1 = 2,85
n(O) = 22,78/16 = 1,42375
n(Ba) = 48,75/137 = 0,356
Η αναλογία των στοιχείων στο επιθυμητό αλάτι έχει ως εξής:
6:8:4:1 (S:N:O:Wa)
Μοριακός τύπος της ουσίας C 6 H 8 O 4 Va
Λαμβάνοντας υπόψη την αναλογία άνθρακα και υδρογόνου που χαρακτηρίζει ένα ακόρεστο μονοβασικό οξύ ή ένα κορεσμένο διβασικό οξύ, καθώς και την αντίδραση σχηματισμού μιας καρβονυλικής ένωσης κατά τη θέρμανση, μπορούμε να συμπεράνουμε ότι μιλάμε για το άλας βαρίου του βουτανίου-1 ,2-δικαρβοξυλικό οξύ

17 επιλογή
Κατά την καύση 40 g μιας οργανικής ένωσης, σχηματίστηκαν 4,48 l CO 2 και 2,88 g H 2 O. Η ουσία αποχρωματίζει το βρωμιούχο νερό και αντιδρά με διάλυμα υδροξειδίου του βαρίου όταν θερμαίνεται, ένα από τα προϊόντα έχει τον τύπο C 6 H 6 O 4 Ba. Προσδιορίστε τον μοριακό και δομικό τύπο της ουσίας.
Απόφαση
Η επιθυμητή ουσία περιέχει πολλαπλό δεσμό άνθρακα-άνθρακα, αφού αποχρωματίζει το βρωμιούχο νερό.
Λαμβάνοντας υπόψη τις πληροφορίες σχετικά με την αντίδραση μιας ουσίας με υδροξείδιο του βαρίου για να σχηματιστεί ένα οργανικό άλας βαρίου, μπορούμε να συμπεράνουμε ότι η επιθυμητή ουσία περιέχει είτε μια καρβοξυλομάδα είτε έναν δεσμό εστέρα.
Ο γενικός τύπος της ουσίας CxHyOz
Να βρείτε την αναλογία των ποσοτήτων άνθρακα και υδρογόνου:
n(C) = 4,48/22,4 = 0,2
n (H) \u003d 2,88 * 2/18 \u003d 0,32
Έτσι, η αναλογία των ποσοτήτων ουσιών άνθρακα και υδρογόνου είναι 5:8
Δεδομένου του τύπου του προϊόντος που καθορίζεται στη συνθήκη, συμπεραίνουμε ότι το προπενοϊκό οξύ: CH 2 \u003d CH-C (O) -O-Ba-O-C (O) -CH \u003d CH 2
Το βίντεο μάθημα «Get an A» περιλαμβάνει όλα τα απαραίτητα θέματα για την επιτυχή επιτυχία της εξέτασης στα μαθηματικά κατά 60-65 μονάδες. Πλήρως όλες οι εργασίες 1-13 εξετάσεις προφίλμαθηματικά. Κατάλληλο και για να περάσει η Βασική ΧΡΗΣΗ στα μαθηματικά. Αν θέλετε να περάσετε τις εξετάσεις με 90-100 μόρια, πρέπει να λύσετε το μέρος 1 σε 30 λεπτά και χωρίς λάθη!
Μαθήματα προετοιμασίας για τις εξετάσεις για τις τάξεις 10-11, καθώς και για καθηγητές. Όλα όσα χρειάζεστε για να λύσετε το μέρος 1 της εξέτασης στα μαθηματικά (τα πρώτα 12 προβλήματα) και στο πρόβλημα 13 (τριγωνομετρία). Και αυτά είναι περισσότερα από 70 μόρια στην Ενιαία Κρατική Εξέταση και ούτε ένας μαθητής εκατό βαθμών ούτε ένας ανθρωπιστής δεν μπορούν να τα κάνουν χωρίς αυτά.
Όλη η απαραίτητη θεωρία. Γρήγοροι τρόποιλύσεις, παγίδες και μυστικά της εξέτασης. Όλες οι σχετικές εργασίες του μέρους 1 από τις εργασίες της Τράπεζας FIPI έχουν αναλυθεί. Το μάθημα συμμορφώνεται πλήρως με τις απαιτήσεις του USE-2018.
Το μάθημα περιέχει 5 μεγάλα θέματα, 2,5 ώρες το καθένα. Κάθε θέμα δίνεται από την αρχή, απλά και ξεκάθαρα.
Εκατοντάδες εργασίες εξετάσεων. Προβλήματα κειμένουκαι η θεωρία πιθανοτήτων. Απλοί και εύκολοι στην απομνημόνευση αλγόριθμοι επίλυσης προβλημάτων. Γεωμετρία. Θεωρία, υλικό αναφοράς, ανάλυση όλων των τύπων εργασιών USE. Στερεομετρία. Πονηρά κόλπα για επίλυση, χρήσιμα cheat sheets, ανάπτυξη χωρικής φαντασίας. Τριγωνομετρία από το μηδέν - στην εργασία 13. Κατανόηση αντί να στριμώχνουμε. Οπτική εξήγηση σύνθετων εννοιών. Αλγεβρα. Ρίζες, δυνάμεις και λογάριθμοι, συνάρτηση και παράγωγος. Βάση επίλυσης σύνθετων προβλημάτων του 2ου μέρους της εξέτασης.